
【题目】下列方程式不能正确表示某沉淀溶解过程的是
A.热的浓盐酸洗涤试管内壁的MnO2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.热的NaOH溶液洗涤试管内壁的S:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
C.向石灰石粉的悬浊液中持续通CO2:Ca(OH)2+2CO2=Ca(HCO3)2
D.稀硫酸可除去铁锈:Fe2O3+6H+=2Fe3++3H2O
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】反应原理在工业的应用:
(1)科研人员将粗锰(含杂质的锰)粉碎后加入到SnCl2溶液中使其溶解浸出(假定杂质不反应,溶液体积不变),发生反应Mn(s)+ Sn2+(aq)![]() Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
Mn2+(aq)+ Sn(s),为加快反应速率可以采取的措施________;不考虑温度因素,一段时间后Mn的溶解速率加快,可能的原因是_______。
(2)常温下,Ksp(FeS)=1×10-18,FeS饱和溶液中[H+]与[S2-]之间存在关系:[H+]2·[S2-]=1.0×10-22,为了使溶液里c(Fe2+) 达到1 mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的PH=_______。
(3)工业上利用含镍废水(镍主要以NiR2络合物形式存在制取草酸镍(NiC2O4),工艺流程如图所示:

已知:Ⅰ:NiR2(aq)![]() Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ni2+(aq)+2R-(aq) (R-为有机物配体,K=1.6×10-14)
Ⅱ:Ksp[Fe(OH)3]=1×10-38,Ksp[Ni(OH)2]=2×10-15
Ⅲ:“脱络”过程中,R-能与·OH(Fe2+和H2O2反应产生的中间产物)反应生成·R(有机物自由基)
①“沉铁”时,若溶液中c(Ni2+)=0.01mol·L-1,加入碳酸钠调溶液的pH=________(假设溶液体积不变)使Fe3+恰好沉淀完全(离子的浓度≤1.0×10-5mol·L-1),此时________(填“有”或“无”)Ni(OH)2沉淀生成。
②“沉镍”即得到草酸镍沉淀,其离子方程式是______________________
③NiR2中加入Fe2+和H2O2能够实现“脱络”的原因是_________________
(4)Na2SO3氧化反应:2Na2SO3+O2=2Na2SO4其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。为确定贫氧区速率方程![]() 中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
中a的值(取整数),分析实验数据。当溶解氧浓度为4. 0 mg·L-1时,c(Na2SO3)与速率数值关系如下表,则a=______。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列各化合物中,属于同系物的是_____,属于同分异构体的是____。
A.CH3CH2CH2CHO 与 ![]() B.
B.![]() 与
与 ![]()
C.![]() 与
与 ![]() D.
D.![]() 与
与 ![]()
E.![]() 与
与![]() F.戊烯与环戊烷
F.戊烯与环戊烷
(2) 用系统命名法命名下列物质:
①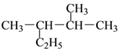 __________________; ②
__________________; ②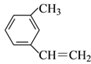 ________________;
________________;
③(CH3)2C=CHCH=CH2 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.做中和热测定实验时,在大小烧杯之间填满碎泡沫塑料以防止热量散失
B.海上石油钢铁钻井平台可用外加电流的阴极保护法以防腐
C.H2O2催化分解每产生1molO2,转移电子的数目为2×6.02×1023
D.25℃时,加水稀释0.1molL﹣1NH4Cl,溶液中![]() 不断增大
不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确且存在因果关系的是
选项 | 实验操作和现象 | 实验结论 |
A | 常温下,取浓度均为0.2mol/L的Na2CO3和NaHCO3溶液各2mL于试管中,分别滴加几滴酚酞试液,后者红色更深。 | 相同温度下,CO32-结合H+能力更强 |
B | 向Na2CrO4溶液中滴加浓硫酸,溶液由橙色变成黄色。 | 增大反应物浓度 平衡正向移动 |
C | 向硅酸钠溶液中通入CO2气体,溶液变浑浊 | 酸性:H2CO3>H2SiO3 |
D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄 | 氧化性:H2O2>Fe3+ |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列互为同位素的是__________;互为同素异形体的是__________;(填序号)
①H2O与H2O2;②金刚石与石墨;③汞与水银;④16O和18O
(2)请写出以下物质或微粒的电子式:H2O__________NaCl__________。
(3)下面是同学们熟悉的物质:O2、HCl、Na2O、NH4Cl、NaOH。这些物质中,只含有离子键的是_________;(填化学式,下同)属于共价化合物的是______;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
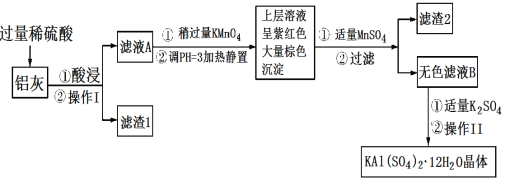
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com