
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
【答案】2.00 n(Fe):n(CuO)=1∶2
【解析】
将固体混合物通足量氢气并加热使之反应完全,固体质量由86.4g变为73.6g,减少的质量为O元素的质量,据此可计算出CuO的质量和物质的量,将用H2还原后的固体混合物用稀硫酸处理,Fe会发生反应形成FeSO4进入溶液,置换出来的Cu单质及可能混有的C单质仍以固体形式存在,过滤,向滤液中加入500mL某浓度NaOH溶液,NaOH先与过量的硫酸发生复分解反应,然后是NaOH与FeSO4发生复分解反应产生的沉淀为Fe(OH)2,将沉淀灼烧得固体是Fe2O3,质量是32.0g。根据Fe元素守恒可得Fe的质量,结合Fe、CuO的质量和与86.4g进行比较,可判断是否含有C元素及其质量大小。
(1)将灼烧后剩余固体用硫酸溶解,Fe变为FeSO4,加入NaOH溶液时,发生反应:H2SO4+2NaOH=Na2SO4+2H2O,FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,将固体过滤、洗涤,灼烧,Fe(OH)2变为Fe2O3,质量是32.0g,n(Fe2O3)=![]() ,n(Fe)=2n(Fe2O3)=0.4mol,根据Na、S元素守恒可得n(NaOH)=2n(H2SO4)=2×0.500mol/L×1L=1.000mol,由于NaOH溶液的体积为500mL,所以c(NaOH)=
,n(Fe)=2n(Fe2O3)=0.4mol,根据Na、S元素守恒可得n(NaOH)=2n(H2SO4)=2×0.500mol/L×1L=1.000mol,由于NaOH溶液的体积为500mL,所以c(NaOH)=![]() ;
;
(2)根据(1)分析可知n(Fe)=2n(Fe2O3)=0.4mol,m(Fe)=0.4mol×56g/mol=22.4g,由于原混合物质量是86.4g,用足量氢气还原后得到固体质量为73.6g,减少质量为其中含有的O元素的质量,n(O)=n(CuO)=![]() =0.8mol,根据Cu元素守恒可知n(CuO)=n(Cu)=0.8mol,则m(CuO)=0.8mol×80g/mol=64g,64g+22.4g=86.4g,CuO与Fe粉的质量和恰好为原固体的质量,说明原固体中只含有CuO、Fe单质,n(Fe):n(CuO)=0.4mol:0.8mol=1:2。
=0.8mol,根据Cu元素守恒可知n(CuO)=n(Cu)=0.8mol,则m(CuO)=0.8mol×80g/mol=64g,64g+22.4g=86.4g,CuO与Fe粉的质量和恰好为原固体的质量,说明原固体中只含有CuO、Fe单质,n(Fe):n(CuO)=0.4mol:0.8mol=1:2。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】在下图所示的物质转化关系中,A是常见的气态氢化物,B是能使带火星的木条复燃的无色无味气体,E的相对分子质量比D大17,G是一种紫红色金属单质。(部分反应中生成物没有全部列出,反应条件未列出)。回答下列问题:
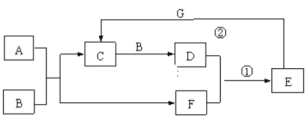
⑴A的电子式为__________。
⑵反应①的化学方程式为_______,该反应的氧化剂和还原剂的物质的量之比为________;
⑶反应②的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)![]() MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是

选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体粉末 X 中可能含有 Fe2O3、CuO、MnO2、CaO、NaCl 和 K2CO3 中的若干种。为确定该固体粉末的成分,进行了以下实验(所加试剂均过量):
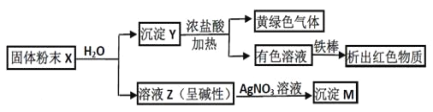
下列结论正确的是:
A. 固体粉末中一定含 K2CO3B. X 中可能存在 Fe2O3
C. 沉淀 M 一定含 AgClD. 沉淀 Y 中不一定存在 MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2![]() 2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜片放入 115mL 某浓度的浓硫酸中,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500mL,再加入足量锌粉,使之充分反应,收集到 2.24L(标准状况下)氢气。过滤残留固体,干燥后称量,质量减轻了 7.5g。求原硫酸的物质的量浓度________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某食用香料乙酸橙花酯的结构简式如图所示,则关于该有机物叙述中正确的个数是( )

①分子式为C12H20O2 ②它的同分异构体中有芳香族化合物 ③能使酸性KMnO4溶液褪色 ④1mol该有机物在一定条件下能和3mol H2反应 ⑤密度比水小 ⑥1mol该有机物水解时能消耗1molNaOH⑦能在一定条件下生成高分子化合物
A. 3个 B. 4个 C. 5个 D. 6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式不能正确表示某沉淀溶解过程的是
A.热的浓盐酸洗涤试管内壁的MnO2:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.热的NaOH溶液洗涤试管内壁的S:3S+6NaOH![]() 2Na2S+Na2SO3+3H2O
2Na2S+Na2SO3+3H2O
C.向石灰石粉的悬浊液中持续通CO2:Ca(OH)2+2CO2=Ca(HCO3)2
D.稀硫酸可除去铁锈:Fe2O3+6H+=2Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是

A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com