
【题目】下列图示与对应的叙述相符的是

A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2![]() 2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
科目:高中化学 来源: 题型:
【题目】工业上用丁烷催化脱氢侧备丁烯:C4H10(g)![]() CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
CH4(g)+H2(g)(正反应吸热)。将丁烷和氢气以一定的配比通过填充有催化剂的反应器(氢气的作用是活化催化剂),反应的平衡转化率、产率与温度、投料比有关。下列判断不正确的是
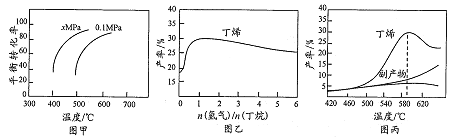
A. 由图甲可知,x小于0.1
B. 由图乙可知,丁烯产率先增大后减小,减小的原因是氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速 率减小
C. 由图丙可知产率在590℃之前随温度升高面增大的原因可能是溫度升高平衡正向移动
D. 由图丙可知,丁烯产率在590℃之后快速降低的主要原因为丁烯高温分解生成副产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
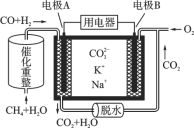
A. 反应CH4+H2O![]() 3H2+CO,每消耗1 mol CH4 转移2 mol 电子
3H2+CO,每消耗1 mol CH4 转移2 mol 电子
B. 电极A上H2参与的电极反应为:H2+2OH--2e-===2H2O
C. 电池工作时,CO32-向电极B移动
D. 电极B上发生的电极反应为:O2+2CO2+4e-===2CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
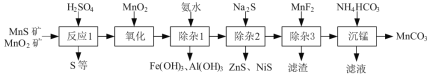
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl为原料可制取下列物质,下列说法正确的是
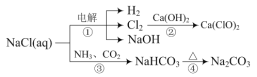
A.工业上是用阴离子交换膜电解槽作为反应①的发生装置
B.漂白粉久置于空气中变质时既发生非氧化还原反应,也发生氧化还原反应
C.反应③是侯氏制碱法,生产过程中先通入CO2,再通入NH3
D.可以用澄清石灰水检验反应④后所得固体中是否有NaHCO3存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某包黑色固体混合物可能含有铁粉、氧化铜、炭粉中的二种或三种,取 86.4g 此固体混合物通足量氢气并加热使之反应完全,剩余固体质量 73.6g ,将此剩余固体溶于 1000mL0.500mol·L-1 硫酸中,过滤,向滤液中加入 500mL 某浓度 NaOH 溶液,恰好使沉淀完全,将沉淀灼烧得固体 32.0g。试计算:
(1)所用 NaOH 溶液的浓度是____________mol·L-1。
(2)固体混合物的成分及其物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO可通过“CH3CH2OH+4Cl2→CCl3CHO+5HCl”进行制备。
⑴实验室常用KMnO4、MnO2或NaClO与浓盐酸反应制取Cl2。质量分数为36.5%,密度为1.18 g·cm-3盐酸,其物质的量浓度为______mol·L1。等物质的量的KMnO4、MnO2或NaClO与足量浓盐酸反应,理论上生成的Cl2的质量之比为______。
⑵可用如下方法测定所制CCl3CHO粗品的纯度(杂质不参与反应):称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,加入一定量的NaOH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL。实验中所发生反应如下:CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑, I2+2Na2S2O3=2NaI+Na2S4O6,计算粗品中所含CCl3CHO的质量分数(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.做中和热测定实验时,在大小烧杯之间填满碎泡沫塑料以防止热量散失
B.海上石油钢铁钻井平台可用外加电流的阴极保护法以防腐
C.H2O2催化分解每产生1molO2,转移电子的数目为2×6.02×1023
D.25℃时,加水稀释0.1molL﹣1NH4Cl,溶液中![]() 不断增大
不断增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com