
【题目】以NaCl为原料可制取下列物质,下列说法正确的是
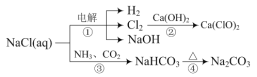
A.工业上是用阴离子交换膜电解槽作为反应①的发生装置
B.漂白粉久置于空气中变质时既发生非氧化还原反应,也发生氧化还原反应
C.反应③是侯氏制碱法,生产过程中先通入CO2,再通入NH3
D.可以用澄清石灰水检验反应④后所得固体中是否有NaHCO3存在
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】大气中氮氧化物和碳氢化合物受紫外线作用可产生一次污染物——光化学烟雾,其中部分物质的反应过程如图所示。下列说法正确的是( )

A.该过程中![]() 作催化剂B.反应过程中没有电子转移
作催化剂B.反应过程中没有电子转移
C.反应过程中氮氧化物不断被消耗D.丙烯转化为甲醛和乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在生产生活中都具有重要的作用和意义:
(1)图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图:该电池的负极反应式为:_________,若串联该燃料电池来电解硫酸钠溶液,消耗4.6g二甲醚后总共可在电解池两极收集到13.44L(标况)气体,该套装置的能量利用率为___________.(保留三位有效数字)

(2)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_______。电解后,____室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,答下列问题:
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:电解时发生反应的化学方程式为______。溶液X中大量存在的阴离子有___。

(4)测定混合气中ClO2的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用50 mL水溶解后,再加入 3 mL稀硫酸. 将一定量的混合气体通入混合溶液中充分吸收, 发生反应: 2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
Ⅱ.用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),以淀粉溶液为指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。
①滴定至终点的现象是______, 测得混合气中ClO2的质量为______ g。
②测定混合气中ClO2的含量的操作中可能使测定结果偏低的是____(填字母)。
A.滴定管未润洗就直接注入硫代硫酸钠标准液
B.锥形瓶用蒸馏水洗净后没有干燥
C.滴定管读取标准液体积时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是

A. 正极反应式:Ca + 2Cl--2e- = CaCl2
B. 放电过程中,Li+向负极移动
C. 没转移0.1mol电子,理论上生成20.7 g Pb
D. 常温时,在正负极间接上电流表或检流计,指针不偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示镁条与盐酸反应的能量变化
B.图2表示H2SO4溶液中滴入BaCl2溶液后,溶液的导电性随BaCl2物质的量的变化
C.图3表示电解精炼铜时,溶液中Cu2+的物质的量浓度随转移电子物质的量的变化
D.图4表示其他条件一定,反应2SO2+O2![]() 2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
2SO3在有、无催化剂情况下SO2的体积分数随时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求写出相应的方程式
⑴某小组同学合作探究铝铁混合物分离的工艺流程如下图甲:


图甲 图乙
①气体A能使湿润的红色石蕊试纸变蓝,则加热时“反应1”的离子方程式为______(用单线桥标出反应电子转移的方向和数目)。
②“反应2”的离子方程式为______。
③气体A能发生如图乙所示的转化,该转化的总反应的化学方程式为______。
⑵由工业废气制备Na2S2O4的实验原理如下:

①“氧化”时Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,写出“氧化”反应的化学方程式:______。
②写出“电解”反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯。已知:
制备环己烯。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
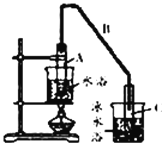
①写出环己醇制备环己烯的化学反应方程式:_________。
②A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_____________。
③试管C置于冰水浴中的目的是_______________________。
(2)环己烯粗品中含有环己醇和少量酸性杂质等,需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在______层(填上或下);分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环己烯热馏,蒸馏时要加入生石灰,目的是__________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分地区水资源缺乏,海水淡化是永恒的话题。下列有关海水淡化的说法错误的是
A.如图制备蒸馏水方法技术成熟,但是成本太高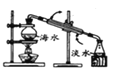
B.如图制备蒸馏水的过程,利用了清洁能源太阳能,且可分离出海水中的盐类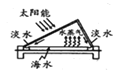
C.如图是离子交换法制备淡水,在阴阳离子交换后发生了酸碱中和反应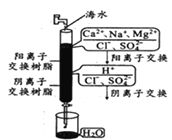
D.如图在阳离子交换过程中阳离子数目保持不变,溶液酸碱性也保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com