
【题目】请按要求写出相应的方程式
⑴某小组同学合作探究铝铁混合物分离的工艺流程如下图甲:


图甲 图乙
①气体A能使湿润的红色石蕊试纸变蓝,则加热时“反应1”的离子方程式为______(用单线桥标出反应电子转移的方向和数目)。
②“反应2”的离子方程式为______。
③气体A能发生如图乙所示的转化,该转化的总反应的化学方程式为______。
⑵由工业废气制备Na2S2O4的实验原理如下:

①“氧化”时Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,写出“氧化”反应的化学方程式:______。
②写出“电解”反应的离子方程式:_____。
【答案】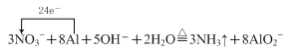 AlO2-+ CO2+2H2O=Al(OH)3↓ +HCO3- 2NH3+3NaClO=N2+3NaCl+3H2O 4NO+6 Ce(SO4)2+5H2O=3 HNO2+HNO3+3Ce2(SO4)3+3H2SO4 2Ce3++2SO32 +4H+
AlO2-+ CO2+2H2O=Al(OH)3↓ +HCO3- 2NH3+3NaClO=N2+3NaCl+3H2O 4NO+6 Ce(SO4)2+5H2O=3 HNO2+HNO3+3Ce2(SO4)3+3H2SO4 2Ce3++2SO32 +4H+![]() S2O42-+2Ce4++2H2O
S2O42-+2Ce4++2H2O
【解析】
⑴①气体A能使湿润的红色石蕊试纸变蓝,说明该气体具有碱性,故A为氨气,则加热时金属铝和硝酸钠、氢氧化钠溶液发生氧化还原反应生成氨气和偏铝酸钠,铝化合价升高作还原剂,硝酸钠中氮元素化合价降低,作氧化剂,根据得失电子守恒,物料守恒,“反应1”的离子方程式为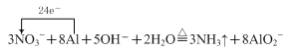 ;
;
答案为: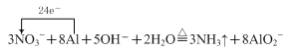 。
。
②由“反应1”得到的滤液中含有偏铝酸根离子,通入过量二氧化碳,生成氢氧化铝白色沉淀和碳酸氢钠,“反应2”的离子方程式为AlO2-+ CO2+2H2O=Al(OH)3↓+HCO3-;
答案为:AlO2-+ CO2+2H2O=Al(OH)3↓+HCO3-。
③如图乙所示,发生的反应为①NaClO+H2O=NaOH+HClO;②3HClO+2NH3= N2+3H2O+3HCl;③NaOH+ HCl=NaCl+ H2O;①×3+②+③×3,可得2NH3+3NaClO=N2+3NaCl+3H2O,
答案为:2NH3+3NaClO=N2+3NaCl+3H2O。
⑵ 由工业废气制备Na2S2O4的实验原理如下:
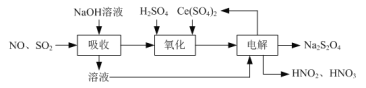
①依据流程图,一氧化氮和二氧化硫混合气体通入氢氧化钠溶液,二氧化硫被吸收生成亚硫酸钠,用硫酸调节溶液pH值,一氧化氮与Ce(SO4)2发生氧化还原反应,Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,结合得失电子守恒和料守恒,反应的化学方程式:4NO+6 Ce(SO4)2+5H2O=3 HNO2+HNO3+3Ce2(SO4)3+3H2SO4
答案为:4NO+6 Ce(SO4)2+5H2O=3HNO2+HNO3+3Ce2(SO4)3+3H2SO4。
②根据流程图,对吸收流程产生的Na2SO3和氧化后的Ce2(SO4)3的酸性混合溶液电解生成Ce(SO4)2和Na2S2O4,根据电荷守恒及物料守恒, “电解”反应的离子方程式:2Ce3++2SO32 +4H+![]() S2O42-+2Ce4++2H2O。
S2O42-+2Ce4++2H2O。
答案为:2Ce3++2SO32 +4H+![]() S2O42-+2Ce4++2H2O。
S2O42-+2Ce4++2H2O。


科目:高中化学 来源: 题型:
【题目】常温时,配制一组c(Na2CO3)+c(NaHCO3)=0.100mol·L-1的混合溶液,溶液中c(CO32-)、c(HCO3-)与pH的关系如图所示。下列说法中错误的是
(己知:CO32-+H2O![]() HCO3-+OH- K=2×10-4,1g5=0.7)
HCO3-+OH- K=2×10-4,1g5=0.7)
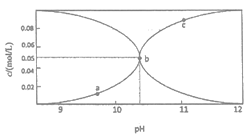
A. a点的溶液中:c(HCO3-)>c(H2CO3)+c(CO32-)
B. b点横坐标数值大约为10.3
C. c点的溶液中:c(Na+)<2c(CO32-)十c(HCO3-)
D. 溶液中水的电离程度:a<b<c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向xmL 0. 1 mol/L氨水中滴加等物质的量浓度的稀H2SO4 ,测得混合溶液的温度和pOH[pOH==-lg c(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化)。下列说法不正确的是

A. x=40
B. a, b,c三点由水电离出的c(H+)依次减小
C. b点时溶液的pOH>pH
D. a,b.d三点对应的NH3·H2O的电离常数:K(b)>K(d)>K(a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl为原料可制取下列物质,下列说法正确的是
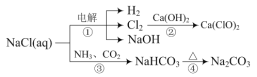
A.工业上是用阴离子交换膜电解槽作为反应①的发生装置
B.漂白粉久置于空气中变质时既发生非氧化还原反应,也发生氧化还原反应
C.反应③是侯氏制碱法,生产过程中先通入CO2,再通入NH3
D.可以用澄清石灰水检验反应④后所得固体中是否有NaHCO3存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂:某学习小组为探究其分解产物设计如下实验装置。

硫酸亚铁铵在500 ℃时隔绝空气加热完全分解,固体产物可能有 FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O
(1)A 中固体充分加热较长时间后,通入氮气,目的是 _______________ 。
(2)能证明气体产物中有SO2 的实验现象是____________
(3)设计一个实验方案,用化学方法证明固体产物不含二价铁:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CCl3CHO可通过“CH3CH2OH+4Cl2→CCl3CHO+5HCl”进行制备。
⑴实验室常用KMnO4、MnO2或NaClO与浓盐酸反应制取Cl2。质量分数为36.5%,密度为1.18 g·cm-3盐酸,其物质的量浓度为______mol·L1。等物质的量的KMnO4、MnO2或NaClO与足量浓盐酸反应,理论上生成的Cl2的质量之比为______。
⑵可用如下方法测定所制CCl3CHO粗品的纯度(杂质不参与反应):称取该实验制备的产品5.00 g,配成100.00 mL溶液,取其中10.00 mL,加入一定量的NaOH后,加入30.00 mL 0.100 mol·L1的碘标准液,用0.100 mol·L1的Na2S2O3溶液滴定,重复上述3次操作,消耗Na2S2O3溶液平均体积为20.00 mL。实验中所发生反应如下:CCl3CHO+NaOH=CHCl3+HCOONa,HCOONa+I2=HI+NaI+CO2↑, I2+2Na2S2O3=2NaI+Na2S4O6,计算粗品中所含CCl3CHO的质量分数(写出计算过程)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
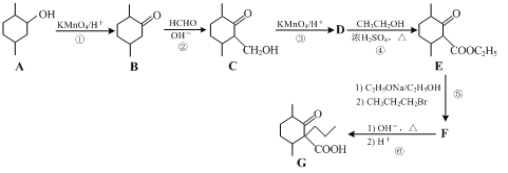
⑴下列说法正确的是______。
A.可以用NaHCO3溶液鉴别化合物A和G
B.有机物A分子中只含有2个手性碳原子
C.化合物B分子中所有碳原子可能位于同一平面
D.1 mol化合物E最多可与1 mol NaOH反应
⑵反应②的反应类型是______。
⑶化合物F的结构简式是______。
⑷写出一种满足下列条件的C的同分异构体的结构简式:______。
Ⅰ.含有六元环;Ⅱ.能发生银镜反应和水解反应;Ⅲ.分子含5种不同化学环境的氢。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O=O:498,则反应P4(白磷)+3O2=P4O6中消耗3 mol O2放出的热量为
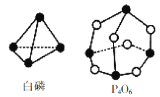
A.1368kJB.1498kJC.1638kJD.1683kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )

A. H2A为二元弱酸,稀释前c(H2A)=0.005mol/L
B. NaHA水溶液中:c(Na+)+ c(H+)= 2c(A2-)+ c(OH-)
C. 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)= c(A2-)+ c(B2-)+ c(HB-)+ c(H2B)
D. pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com