
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂:某学习小组为探究其分解产物设计如下实验装置。

硫酸亚铁铵在500 ℃时隔绝空气加热完全分解,固体产物可能有 FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O
(1)A 中固体充分加热较长时间后,通入氮气,目的是 _______________ 。
(2)能证明气体产物中有SO2 的实验现象是____________
(3)设计一个实验方案,用化学方法证明固体产物不含二价铁:________________
【答案】使分解产生的气体在B、C中被吸收充分 C 中产生白色浑浊 取少量固体样品,加入稀硫酸溶解,加入酸性KMnO4溶液,不褪色(或加入K3Fe(CN)6溶液,不产生蓝色沉淀)
【解析】
硫酸亚铁铵在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O,SO3溶于水反应产生硫酸,装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+。据此解答。
硫酸亚铁铵在500℃时隔绝空气加热完全分解,固体产物可能有FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O,装置B中BaC12溶液的作用是为了检验分解产物中是否有SO3气体生成,若含有该气体,会生成硫酸钡白色沉淀,观察到的观象为溶液变浑浊,C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4,则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+。
(1)待A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在B、C装置中完全吸收;
(2)SO2与H2O2会发生反应:SO2+H2O2=H2SO4,反应产生的硫酸与BaCl2溶液发生复分解反应:Ba2++SO42-=BaSO4↓,BaSO4是白色沉淀,因此能证明气体产物中有SO2的实验现象是C中生成了白色沉淀;
(3)利用二价铁离子具有还原性设计实验检验其存在,实验设计为:取少量固体于试管中,加稀硫酸溶解,然后向其中滴入酸性KMnO4溶液,若酸性KMnO4溶液不褪色,证明此固体产物不含二价铁。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是
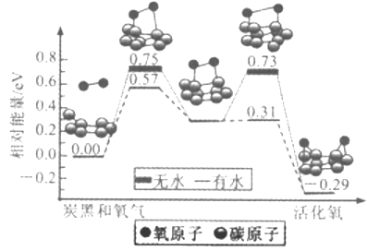
A. 氧分子的活化包括O-O键的断裂与C-O键的生成
B. 每活化一个氧分子放出0.29eV的能量
C. 水可使氧分子活化反应的活化能降低0.42eV
D. 炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,向100 mL H2S饱和溶液中通入SO2气体,所得溶液pH变化如图所示。下列分析正确的是

A. a点对应溶液的导电性比d点强
B. 氢硫酸的酸性比亚硫酸的酸性强
C. 向d点对应的溶液中加入Ba(NO3)2溶液,产生BaSO4白色沉淀
D. H2S饱和溶液的物质的量浓度为0.05 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物 A 由两种元素组成,某研究小组按如图流程探究其组成,其中 D 是一种能使品红溶液褪色的气体。
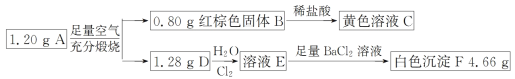
请回答下列问题:
(1)化合物 A 的组成元素有______。(填元素符号)
(2)写出 A→B+D 的化学方程式_________。
(3)写出 D→E 的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求写出相应的方程式
⑴某小组同学合作探究铝铁混合物分离的工艺流程如下图甲:


图甲 图乙
①气体A能使湿润的红色石蕊试纸变蓝,则加热时“反应1”的离子方程式为______(用单线桥标出反应电子转移的方向和数目)。
②“反应2”的离子方程式为______。
③气体A能发生如图乙所示的转化,该转化的总反应的化学方程式为______。
⑵由工业废气制备Na2S2O4的实验原理如下:

①“氧化”时Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,写出“氧化”反应的化学方程式:______。
②写出“电解”反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 仅用水不能区分已烷、溴乙烷、乙醇三种液态有机物
B. 碳原子数小于或等于6的单烯烃,与HBr加成反应的产物只有1种结构,符合条件的单烯烃有3种
C. 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则![]() >d
>d
D. 等质量的烃完全燃烧,耗氧量最多的是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上合成![]() 的反应为
的反应为 ,下列有关说法不正确的是( )
,下列有关说法不正确的是( )
A. X、Y、Z三种有机物均易发生加成反应
B. X、Y、Z三种有机物分子中所有原子均有可能共平面
C. X、Y、Z三种有机物使酸性高锰酸钾溶液褪色的原理相同
D. Z的二氯代物有7种(不考虑立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com