
【题目】已知化合物 A 由两种元素组成,某研究小组按如图流程探究其组成,其中 D 是一种能使品红溶液褪色的气体。
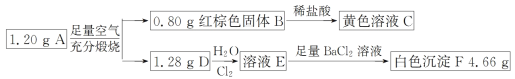
请回答下列问题:
(1)化合物 A 的组成元素有______。(填元素符号)
(2)写出 A→B+D 的化学方程式_________。
(3)写出 D→E 的离子方程式________。
【答案】Fe、S 4FeS2+11O2![]() 2Fe2O3+8SO2 SO2+Cl2+2H2O =4H++SO42-+2Cl-
2Fe2O3+8SO2 SO2+Cl2+2H2O =4H++SO42-+2Cl-
【解析】
化合物 A 由两种元素组成,在足量的空气中煅烧产生红棕色固体B和能使品红溶液褪色的气体D,则B是Fe2O3, 可知A中含有Fe元素;气体D与Cl2在水中发生反应,向反应后的溶液中加入足量BaCl2溶液产生白色沉淀F是BaSO4,说明氯水氧化了气体D,反应产生的物质是HCl和H2SO4的混合溶液,反应产生的硫酸钡沉淀质量是4.66g,说明A中含有S元素;因此化合物A是Fe、S两种元素形成的化合物;n(Fe2O3)=![]() =0.005mol,n(Fe)=0.01mol,n(SO2)=n(BaSO4)=
=0.005mol,n(Fe)=0.01mol,n(SO2)=n(BaSO4)=![]() =0.02mol,n(Fe):n(S)= 0.01mol:0.02mol=1:2,所以A是化学式是FeS2。
=0.02mol,n(Fe):n(S)= 0.01mol:0.02mol=1:2,所以A是化学式是FeS2。
(1)由以上分析可知,A组成元素为Fe、S,化学式为FeS2;
(2)FeS2高温煅烧,反应产生Fe2O3和SO2,根据电子守恒、原子守恒,可得反应的化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;
2Fe2O3+8SO2;
(3)SO2溶于水,向水溶液中通入氯气,发生氧化还原反应,产生盐酸和硫酸,该反应的离子方程式为:SO2+Cl2+2H2O=4H++SO42-+2Cl-。


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用惰性电极电解饱和食盐水,阴极逸出的气体可使湿润的淀粉碘化钾试纸变蓝
B.粗铜电解精炼时,若电路中通过2mole-,阳极减少64g
C.用惰性电极电解MgCl2溶液所发生反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.在镀件上电镀铜时,镀件应连接电源的负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气中的CO、NO、NO2等有毒气体会危害人体健康,可在汽车尾部加催化转化器,将有毒气体转化为无毒气体。
已知:①2NO(g)+O2(g)=2NO2(g) △H1=-112.3kJ·mol-1
②NO2(g)+CO(g)=NO(g)+CO2(g) △H2=-234kJ·mol-1
③N2(g)+O2(g)=2NO(g) △H3=+179.5kJ·mol-1
请写出CO和NO2生成无污染气体的热化学方程式___。
(2)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。
N2(g)+2CO2(g) △H=-759.8kJ·mol-1,反应达到平衡时,N2的体积分数随n(CO)/n(NO)的变化曲线如图1。

①b点时,平衡体系中C、N原子个数之比接近___;
②a、b、c三点CO的转化率从大到小的顺序为___;a、c、d三点的平衡常数从大到小的顺序为___。
③若n(CO)/n(NO)=0.8,反应达平衡时,N2的体积分数为20%,则CO的转化率为__。
(3)若将NO2与O2通入甲中设计成如图2所示装置,D电极上有红色物质析出,则A电极处通入的气体为____(填化学式);A电极的电极反应式为____;一段时间后,若乙中需加0.2molCu(OH)2使溶液复原,则转移的电子数为___。
(4)已知:25℃时,H2C2O4的电离常数Ka1=5.9×10—2,Ka2=6.4×10-5,则25℃时,0.1mol·L-1NaHC2O4溶液中各离子浓度由大到小的顺序为____,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液呈___(填“酸性”“碱性”或“中性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
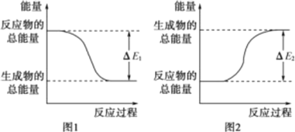
A.铵盐和碱混合即可反应,其能量变化符合图 1
B.0.1mol H2SO4 溶液和 0.1mol Ba(OH)2 溶液的反应符合图 2,且吸收热量为ΔE2
C.0.1mol HCl 溶液和 0.1mol NaOH 溶液的反应符合图 1,且放出热量为ΔE1
D.发生图 1 能量变化的任何反应,一定不需要加热即可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂:某学习小组为探究其分解产物设计如下实验装置。

硫酸亚铁铵在500 ℃时隔绝空气加热完全分解,固体产物可能有 FeO和Fe2O3,气体产物可能有NH3、SO3、SO2、N2和H2O
(1)A 中固体充分加热较长时间后,通入氮气,目的是 _______________ 。
(2)能证明气体产物中有SO2 的实验现象是____________
(3)设计一个实验方案,用化学方法证明固体产物不含二价铁:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
H2O(g)=H2O(l) ΔH=c kJ·mol1
(1)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =______kJ·mol1
(2)H2(g)+1/2O2(g)=1/2H2O(l)的过程如下图所示,H-O键的键能是______kJ·mol1。

(3)某化学兴趣小组用甲醇燃料电池来模拟铝制品表面“钝化”处理过程(装置如图甲所示)。a电极发生的电极反应方程式为______。实验结束后若硫酸溶液质量减少1.08 g,则石墨电极处生成的气体在标准状况下的体积为______L。

(4)一种Na-CO2二次电池装置如图乙所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。充电时的阳极反应式为______。
2Na2CO3+C。充电时的阳极反应式为______。
(5)海水中含有大量的HCO3-,一种利用海水提取CO2的装置如图丙所示。结合方程式简述提取CO2的原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:
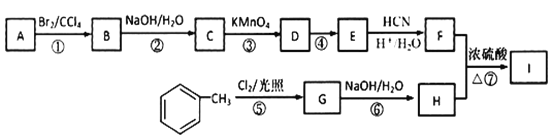
已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸气密度是相同条件下H2的28倍;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
②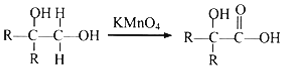 其中R为烃基。
其中R为烃基。
③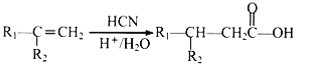 其中R1和R2均为烃基。
其中R1和R2均为烃基。
回答下列问题:
(1)A的结构简式为___________________。
(2)D中官能团的名称是______________________。
(3)反应②的化学方程式为______________。
(4)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是__________(填序号)。
(6)反应⑦的化学方程式为_________________。
(7)参照上述合成路线,以 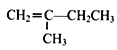 为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料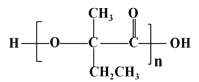 _____________。
_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、T、M、W五种短周期元素在周期表中的相对位置如图所示,其中M的原子序数是R的原子序数的2倍。下列说法正确的是( )

A.简单离子半径大小顺序为r(M)>r(W)>r(Q)>r(R)
B.Q、W的单核离子的核外电子数相等
C.铁常温下不能和M的最高价含氧酸的浓溶液发生化学反应
D.W最低价氢化物的还原性比M最低价氢化物的还原性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com