
【题目】离子化合物是离子通过离子键结合成的化合物。下列物质不属于离子化合物的是( )
A.MgF2B.NaOHC.H2OD.NaCl
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是( )
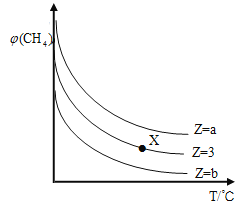
A.该反应的焓变△H﹤0
B.图中Z的大小为b >3> a
C.图中X点对应的平衡混合物中![]() =3
=3
D.温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题: 
(1)从氯化钾溶液中得到氯化钾固体,选择装置(填代表装置图的字母,下同);除去自来水中的Cl﹣等杂质,选择装置 .
(2)从碘水中分离出I2 , 选择装置 , 该分离方法的名称为 .
(3)装置A中①的名称是 , 进水的方向是 .
(4)海水中蕴藏着丰富的资源,在实验室中取少量海水,进行如图流程的实验: 
问题1:粗盐中含Ca2+、Mg2+、Fe3+、SO42﹣等杂质,需要提纯后才能综合利用.
粗盐提纯的步骤有:
①加入过量的Na2CO3溶液; ②加入过量的BaCl2溶液; ③加入过量的NaOH溶液;
④调节溶液的pH等于7; ⑤溶解; ⑥过滤; ⑦蒸发.
正确的操作顺序是(填写序号字母).
a.⑤②③①⑥④⑦b.⑤①②③⑥④⑦c.⑤②①③④⑥⑦d.⑤③①②⑥④⑦
问题2:按所选顺序操作时,步骤④的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 
(1)该“84消毒液”的物质的量浓度约为(保留两位有效数字)
(2)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为25%的消毒液(必须用到容量瓶).下列说法正确的是(填序号).
A.如图所示的仪器中,有三种是不需要的,还需要一种玻璃仪器
B.容量瓶用蒸馏水洗净后,应烘干后才能用于溶液配制
C.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒可能导致结果偏低
D.需要称量NaClO固体的质量为143.0g
(3)若实验遇下列情况,则所配溶液的物质的量浓度是:(用“偏低”,“偏高,“不变”回答)
Ⅰ.定容时俯视刻度线;
Ⅱ.定容时水多用胶头滴管吸出 .
(4)“84消毒液”与稀硫酸混合使用可增强消毒能力,某消毒小组人员用98%(密度为1.84gcm﹣3)的浓硫酸配制2000mL 2.3molL﹣1的稀硫酸用于增强“84消毒液”的消毒能力.
①所配制的稀硫酸中,H+的物质的量浓度为molL﹣1 .
②需用浓硫酸的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( ) 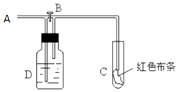
a.D中不可能是浓硫酸 b.D中可以是少量水
c.通入的氯气含有水蒸气 d.D中可以是饱和食盐水.
A.abc
B.bcd
C.abd
D.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:根据离子反应,碳酸根离子与钡离子产生碳酸钡沉淀,硫酸根离子与钡离子产生硫酸钡沉淀,而碳酸钡能与盐酸反应,硫酸钡不溶.
现取50.0mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得到14.51g白色沉淀,用过量稀盐酸处理后沉淀量减少到4.66g,并有气体放出.试计算:
(1)所得白色沉淀中BaCO3的物质的量;
(2)原混合液中Na2CO3的物质的量浓度;
(3)产生的气体在标准状况下的体积.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com