
A、 |
B、 |
C、 |
D、 |
 ,故A错误;
,故A错误; ,故B错误;
,故B错误; ,故C错误;
,故C错误;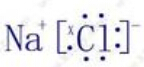 ,故D正确;故选D.
,故D正确;故选D.


科目:高中化学 来源: 题型:
| A、铜锌原电池中铜是负极 |
| B、铜银原电池中铜是正极 |
| C、用电解法精炼粗铜时,粗铜作阳极 |
| D、电解稀硫酸制H2、O2时,铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )
石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景.下列说法正确的是( )| A、石墨烯与石墨互为同位素 |
| B、0.12 g石墨烯中含0.1NA个碳原子 |
| C、石墨烯是一种化合物 |
| D、在整个单层片状结构中属于每个六边形的碳原子数实际为2个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素A、B组成的化合物可能是NH3 |
| B、一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
| C、C、D、E的半径:C>D>E |
| D、化合物AE与CE具有相同类型的化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
32 16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
4 2 |
56 28 |
132 50 |
208 82 |
16 8 |
17 8 |
18 8 |
298 114 |
298 114 |
289 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1KIO3酸性溶液的体积/mL | 0.01mol?L-1KI溶液的体积/mL | H2O的体积 /mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | 5 | 5 | 25 | t1 |
| 实验2 | 4 | 5 | V1 | 25 | t2 |
| 实验3 | 5 | 5 | 5 | 35 | t3 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 完成下列填空:
完成下列填空:| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图所示:则硼氮苯的二氯取代物B3N3H4Cl2的同分异
已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如图所示:则硼氮苯的二氯取代物B3N3H4Cl2的同分异| A、2 | B、3 | C、4 | D、6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com