
| A、36g镁在足量的氮气中完全燃烧共转移的电子数为3NA |
| B、标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢共价键数目为3NA |
| D、1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| 21g |
| 14g/mol |


科目:高中化学 来源: 题型:
| A、标准状况下11.2L的水中含有0.5个NA水分子 |
| B、22.4L N2的所含的电子数是14NA个 |
| C、氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子 |
| D、常温常压下,1mol N2和NO的混合气体中含2NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可以用淀粉检验加碘食盐中的碘元素 |
| B、鱼、肉、虾等食品用福尔马林防腐保鲜 |
| C、油脂可以提供能量,我们炒菜要多放油 |
| D、缺铁会产生贫血,常在酱油中补铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔与氯化氢反应制取氯乙烯 |
| B、乙烷和氯气反应制取氯乙烷 |
| C、乙烯与氢气反应制取乙烷 |
| D、乙烯通入溴的四氯化碳溶液后,使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室内装潢涂料中释放出来的甲醛 |
| B、地砖中释放出的氡等放射性物质 |
| C、水果释放出的酯类物质 |
| D、厨房烧饭时产生的油烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
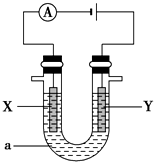 (1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
(1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com