


科目:高中化学 来源: 题型:
| A、向FeCl3溶液中滴加氨水:Fe3++3OH-═Fe(OH)3↓ |
| B、向Na[Al(OH)4]溶液中通入少量CO2:2[Al(OH)4]-+CO2═2Al(OH)3↓+CO32-+H2O |
| C、向Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO |
| D、向NH4HCO3溶液中加入足量NaOH溶液:NH4++OH-═NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Na+、NO3-、SO42- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、K+、Fe3+、Cl-、SCN- |
| D、Na+、Fe2+、Cl2、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、36g镁在足量的氮气中完全燃烧共转移的电子数为3NA |
| B、标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为2NA |
| C、室温下,21.0g乙烯和丁烯的混合气体中含有的碳氢共价键数目为3NA |
| D、1 molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HClO中氯元素化合价比HClO4中氯元素化合价低,所以HClO4的氧化性强 |
| B、已知①Fe+Cu2+═Fe2++Cu;②2Fe3++Cu═2Fe2++Cu2+,则氧化性强弱顺序为:Fe3+>Cu2+>Fe2+ |
| C、已知还原性:B->C->D-,反应 2C-+D2═2D-+C2和反应2C-+B2═2B-+C2都能发生 |
| D、具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ClO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
c(S
| ||
c(HS
|
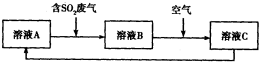
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com