
| m |
| M |
| 448L |
| 22.4L/mol |
| 1000g+730g |
| 1300g/L |
| 33.6L |
| 22.4L/mol |
| 4mol |
| 2 |
| 45g |
| 18g/mol |
| 16g |
| 32g/mol |
| 14g |
| 28g/mol |
| 1.204×1024 |
| 6.02×1023/mol |
| 1 |
| 4 |
| 16 |
| 64 |
| 7 |
| 28 |
| 6 |
| 30 |
| 448L |
| 22.4L/mol |
| 1000g+730g |
| 1300g/L |
| 730g |
| 1000g+730g |
| 20mol |
| 1.33L |


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
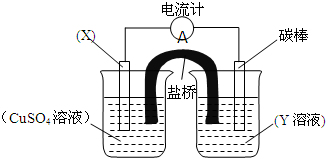 依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
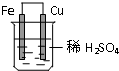 在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )
在盛有稀硫酸的烧杯中放入用导线连接的铁片和铜片,下列叙述正确的是( )| A、正极的反应式为:Cu2++2e-=Cu |
| B、铁片逐渐溶解,反应式为:Fe-3e-=Fe3+ |
| C、负极是电子流入的电极 |
| D、铜片为正极,发生了还原反应,可观察到气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40gNaOH溶于水并配成1L的溶液 |
| B、0.5 L含49gH2SO4的溶液 |
| C、将1molNa2O 溶于水并配成1L的溶液 |
| D、含K+为1mol?L-1的K2SO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com