
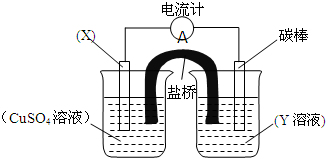
 依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:| 3.2g |
| 64g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 将氯水滴加到含有酚酞的NaOH溶液中 | ||
| ③ | 淀粉KI试纸变蓝色 | 氯水中含有Cl2 | |
| ④ | 将足量的氯水滴加到镁粉中 | 氯水中含有H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、小苏打溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
| B、石灰水与足量的碳酸氢钾溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| C、大理石跟醋酸溶液反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
| D、过氧化钠与水的反应:2O22-+2H2O═4OH-+O2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com