


科目:高中化学 来源: 题型:
| A、可以用淀粉检验加碘食盐中的碘元素 |
| B、鱼、肉、虾等食品用福尔马林防腐保鲜 |
| C、油脂可以提供能量,我们炒菜要多放油 |
| D、缺铁会产生贫血,常在酱油中补铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
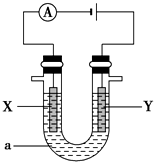 (1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是
(1)原电池反应通常是放热反应,在理论上可设计成原电池的化学反应是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=
(1)一定温度下,向1L密闭容器中加入1mol HI(g),发生2HI(g)?H2(g)+I2(g)反应,H2物质的量随时间的变化如图所示.0~2min内的平均反应速率v(HI)=查看答案和解析>>
科目:高中化学 来源: 题型:
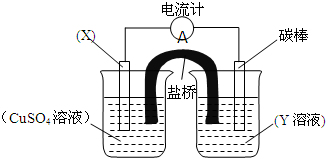 依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Fe3++Cu=Cu2++2Fe2+设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH溶液与醋酸反应 |
| B、KOH溶液与稀盐酸反应 |
| C、Ba(OH)2溶液与稀硫酸反应 |
| D、石灰水与稀硝酸反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com