
| 44.1% |
| 12 |
| 8.82% |
| 1 |
| 47.08% |
| 16 |
| Ũ���� |
| �� |
| Ũ���� |
| �� |
 ��
�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��KClO3��SO3����ˮ���ܵ��磬��KClO3��SO3Ϊ����� |
| B��25��ʱ���ô�����Һ�ζ���Ũ��NaOH��Һ��pH=7��V�����ᣩ��V��NaOH�� |
| C��AgCl������ת����AgI������Ksp��AgX��=c��Ag+��?c��X-������Ksp��AgI����Ksp ��AgCl�� |
| D��BaSO4��ˮ��Һ�����磬��BaSO4��������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ClO2 |
| ��Ӧ�� |
| Na2SO3ˮ��Һ |
| ��Ӧ�� |
c(S
| ||
c(HS
|
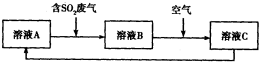
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʵ����� | ʵ�鷽�� | ʵ������ | ���� |
| �� | ����ˮ�μӵ�AgNO3��Һ�� | ���ɰ�ɫ���� | |
| �� | ����ˮ�μӵ����з�̪��NaOH��Һ�� | ||
| �� | ����KI��ֽ����ɫ | ��ˮ�к���Cl2 | |
| �� | ����������ˮ�μӵ�þ���� | ��ˮ�к���H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��С�մ���Һ��ϡ�����ϣ�CO32-+2H+�TCO2��+H2O |
| B��ʯ��ˮ��������̼�������Һ��Ӧ��HCO3-+Ca2++OH-�TCaCO3��+H2O |
| C������ʯ��������Һ��Ӧ��CaCO3+2CH3COOH�TCa2++2CH3COO-+H2O+CO2�� |
| D������������ˮ�ķ�Ӧ��2O22-+2H2O�T4OH-+O2�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com