
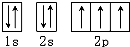
 ,有3个运动状态不同的未成对电子,故答案为:3;
,有3个运动状态不同的未成对电子,故答案为:3;

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| A、H+、Cl-、Na+、SO42- |
| B、Mg2+、NO3-、K+、Br- |
| C、H+、Na+、Cl-、CO32- |
| D、OH-、NO3-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com