
【题目】如图1和图2是A、B两种物质的核磁共振氢谱.请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质的分子式( ) 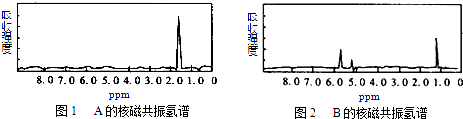
A.A是C3H6、B是C2H6
B.A是C6H6、B是C4H6
C.A是C6H6、B是C2H6
D.A是C3H8、B是C6H6
 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某含氧酸盐X的化学式为ABO3 ;已知在元素周期表中,A、B均为前四周期主族元素,且A位于B的下一周期。
(1)若常温下A、B的单质都能与水发生反应,且A的焰色反应为紫色。
①B在元素周期表中的位置是___________________。
②下列说法正确的是__________(填代号)。
a.A离子的半径大于B离子的半径
b.A、B元素的最高价氧化物对应的水化物都是强电解质
c.A单质与水反应后溶液的pH比B单质与水反应后溶液的pH大
③400℃时,X能发生分解反应生成两种盐,其物质的量之比为1:3,其中一种是无氧酸盐。该反应的化学方程式为_______________________________________________。
(2)若含氧酸盐X难溶于水,在空气中易氧化变质;且B元素原子的最外层电子数是其电子层数的2倍。已知X能快速消除自来水中的C1O—,则该反应的离子方程式为_____________
(3)若含氧酸盐X能与稀硫酸反应,生成无色、无味的气体。
①该气体的电子式为______________。
②X可用作防火涂层,其原因是:
a.高温下X发生分解反应时,吸收大量的热;b.________________________(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 利用丁达尔效应可以区分溶液和胶体
B. 胶体的分散质粒子直径大于1nm小于100nm,但不能通过半透膜
C. PM2.5是指大气中直径接近于2.5×10-6 m(1m=109 nm)的颗粒物,也称可吸入颗粒物,这些细颗粒物分散在空气中形成的分散系是胶体
D. 溶液的分散质粒子直径小于1nm,能通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的流程: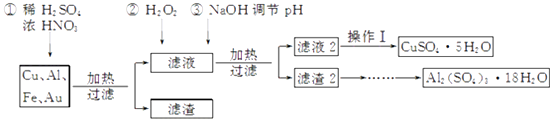
已知:Fe3+、Al3+、Cu2+开始沉淀至沉淀完全的pH范围分别为:2.2~3.2、4.1~5.0、5.3~6.6.
(1)得到滤渣1的主要成分为 .
(2)操作Ⅰ包含的实验步骤有:、冷却结晶、过滤、洗涤、干燥;过滤操作所用到的玻璃仪器有烧杯、玻璃棒和 .
(3)操作Ⅰ中常用无水乙醇对晶体进行洗涤,选用无水乙醇的原因是 .
(4)第②步加H2O2后发生反应的离子方程式为 .
(5)取上述硫酸铝晶体进行热重分析,其热分解主要分为三个阶段:323K~523K,553K~687K,当温度在1 043K以上不再失重,下表列出了不同温度下的失重率:[硫酸铝晶体化学式为Al2(SO4)318H2O,相对分子质量为666]
已知:失重%= ![]() ×100%.
×100%.
温度(K) | 失重(%) | |
第一阶段 | 323~523 | 40.54 |
第二阶段 | 553~687 | 48.65 |
第三阶段 | 1 043以上 | 84.68 |
通过计算确定(写出计算过程):
①失重第一阶段分解产物的化学式;
②失重第二阶段反应的反应化学方程式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠投入滴有石蕊的水中,下列有关现象的叙述中错误的是
A. 钠浮在液面上 B. 有气体产生
C. 水溶液变为红色 D. 钠熔成小球并在水面四处游动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3、MgCl2、MgSO4的混合溶液中,c(Al3+)=0.10mol/L,c(Mg2+)=0.25mol/L,c(Cl-)=0.50mol/L,则c(SO42-)为
A. 0.10mol/L B. 0.15mol/L C. 0.20mol/L D. 0.30mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氧体是一类磁性材料,通式为MO·xFe2O3(M为二价金属离子),如Fe3O4可表示为FeO·Fe2O3,制备流程为:
![]()
根据题意回答:
(1)现称取2.8 g铁粉,加入一定量的稀硫酸使其完全溶解后,再加入_____g的FeCl3固体,经上述反应后,方可得到纯净的Fe3O4;
(2)如果以MgSO4和FeCl3为原料,要获得18.0克MgO·2Fe2O3,在制取过程中至少需要1 mol/L的NaOH溶液____mL;
(3)在一次制备Fe3O4的实验中,由于反应物比例控制不当,获得了另一种产品。取一定量该产品溶于足量盐酸中,还需通入标准状况下672 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液蒸干,灼烧至恒重,得9.6 g固体。该产品的化学式为_______;
(4)有一种在电子工业上应用广泛的含铬铁氧体,其组成可表示为:![]() ,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
,现有15.2 g FeSO4,经Cr2O72-、H2O2等物质处理后(不再引入含铁物质),可得到含铬铁氧体的质量范围为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.石蕊试纸和pH试纸使用前都必须用蒸馏水润湿
B.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
C.电离和水解反应都是吸热过程
D.酸式盐的pH均小于7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com