
【题目】甲醛(HCHO)与葡萄糖相似具有还原性。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50 mL和5 mol·L-1NaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a 20分钟后冷却至室温。
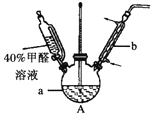
①仪器b的名称是_________;
②能说明甲醛具有还原性的实验现象是_________________。
(2)上述实验有副反应发生,产生的气体为CO、H2中的一种或两种。为确认气体成分,将装置A和如下图所示装置连接后进行实验。
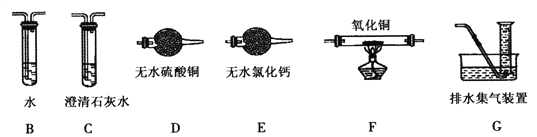
依次连接的合理顺序为A→B→___→____→____→____→G,装置B的作用是_____________。有H2的实验现象是_________________________。
(3)已知:![]() 设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
设计实验证明a中甲醛中的碳元素未被氧化成+4价。写出实验操作、现象、结论______________________。
(4)反应后a中有红色固体产生,为研究其组成,进行如下实验(以下每步均充分反应):
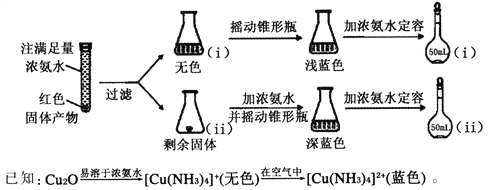
①锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为____________________;
②将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为________________。
【答案】 球形冷凝管 a中出现砖红色物质 E→F→D→C 吸收甲醛蒸气,防止其干扰后续检验 F中黑色固体变红色,D中固体变蓝色 取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价 2Cu+O2+8NH3·H2O=2[Cu(NH3)4]2++4OH-+6H2O n(Cu2O):n(Cu)=1:200
【解析】(1)①根据仪器构造可判断仪器b的名称是球形冷凝管,其作用为冷凝和回流。②甲醛和新制Cu(OH)2混合加热,甲醛被氧化为甲酸,而Cu(OH)2被还原为Cu2O,则A中会有红色固体生成;(2)检验混合气体中含H2不含CO,需要先将气体干燥,通入灼热的氧化铜,将两者转化为H2O和CO2,再依次通过无水硫酸铜和澄清石灰水检验,注意必须先检验水,另外甲醛有挥发性,混杂在气体产物中,因其有还原性,会和氧化铜反应生成水和二氧化碳,影响产物的检验,需要先除去,所以顺序是A→B→E→F→D→C→G;其中装置B的作用是吸收甲醛蒸气,防止其干扰后续检验;有H2的实验现象是F中黑色固体变红色,D中固体变蓝色;(3)由所给信息可知,甲醛中C为0价,甲酸中碳为+2价,碳酸中碳为+4价,要证明没有+4价,即证明没有碳酸生成,在碱性条件下就是检验碳酸根离子的存在,具体操作方法是:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;(4)①由题干信息可知,无色的[Cu(NH3)4]+在空气中会被氧化为蓝色的[Cu(NH3)4]2+],摇动锥形瓶ⅰ的目的就是有利于溶液中[Cu(NH3)4]+与空气中的氧气接触;由颜色红色固体可知产物应该为单质铜,铜与浓氨水、氧气反应的离子方程式为2Cu+8NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;②将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近,说明稀释前,容量瓶ⅱ中溶液浓度为ⅰ中的100倍,即物质的量ⅱ中为ⅰ中100倍,由原子守恒得,n(Cu2O):n(Cu)=1:200。


科目:高中化学 来源: 题型:
【题目】下列实验方案不合理的是
A. 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液
B. 鉴别织物成分是真丝还是人造丝:用灼烧的方法
C. 鉴定苯中无碳碳双键:加入酸性高锰酸钾溶液
D. 鉴别苯乙烯(![]() )和苯:将溴的四氯化碳溶液分别滴加到少量苯乙烯和苯中
)和苯:将溴的四氯化碳溶液分别滴加到少量苯乙烯和苯中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式。低碳经济的概念在中国正迅速从高端概念演变成全社会的行为,在新能源汽车、工业节能等多个领域都大有作为。 请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知:800℃时,化学反应①、反应②对应的平衡常数分别为2.5、1.0。
反应①:2H2(g)+CO(g)![]() CH3OH(g) △H = -90.8kJ mol-1
CH3OH(g) △H = -90.8kJ mol-1
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g) △H= +41.2kJ mol-1
H2O(g)+CO(g) △H= +41.2kJ mol-1
写出用CO2与H2反应制备甲醇的热化学方程式________________________,800℃时该反应的化学平衡常数K的数值为_______________。
现将不同量的CO2 (g)和H2(g)分别通入到容积为2L恒容密闭容器中进行反应②,得到如下二组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
CO2 (g) | H2(g) | H2(g) | CO2 (g) | |||
1 | 900 | 4 | 6 | 1.6 | 2.4 | 2 |
2 | 900 | a | b | c | d | t |
实验2中,若平衡吋,CO2 (g)的转化率小于H2(g),则a、b必须满足的关系是_________。
若在900℃时,另做一组实验,在此容器中加入10mol CO2,5mol H2,2 mol CO,5 mol H2O (g),则此时v正___v逆(填“>”、“>”或“=”)。
(2)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为:CH3OH(g)+CO(g) ![]() HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
HCOOCH3(g) △H=-29.1KJ·mol-1 ,科研人员对该反应进行了研究,部分研究结果如下:
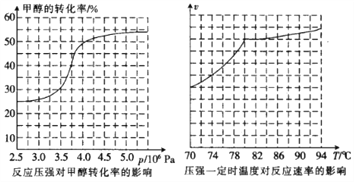
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是____(填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106Pa”)。
②实际工业生产中采用的温度是80℃,其理由是______________________。
(3)已知常温下NH3H2O的电离平衡常数K= 1.75×10-5,H2CO3的电离平衡常数K1=4.4×10-7,K2 =4. 7×10-11。常温下,用氮水吸收CO2可得到NH4HCO3溶液,NH4HCO3溶液呈_____(填“酸性”“中性”或“碱性”),溶液中离子浓度由大到小的顺序为:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物,混合物,强电解质,弱电解质和非电解质的正确组合是
纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
A | 纯盐酸 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
B | 冰醋酸 | 空气 | 硫酸钡 | 亚硫酸 | 二氧化硫 |
C | 氯气 | 盐酸 | 苛性钠 | 氢硫酸 | 碳酸钙 |
D | 漂白粉 | 氨水 | 氯化钠 | 次氯酸 | 氯气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2与SO2能发生反应:NO2+SO2![]() SO3+NO,某研究小组对此进行相关实验探究。
SO3+NO,某研究小组对此进行相关实验探究。
(1)硝酸厂向大气中排放NO2造成的环境问题是_______________。
(2)为了减少SO2的排放,将含SO2的烟气通过洗涤剂X,充分吸收后再向吸收后的溶液中加入稀硫酸,既可以回收SO2,同时又可得到化肥。上述洗涤剂X可以是______(选填序号)。
a.Ca(OH)2 b.K2CO3 c.Na2SO3 d.NH3·H2O
(3)实验中,尾气可以用碱溶液吸收。NaOH溶液吸收NO2时,发生的反应为:2NO2+2OH-=NO2-+NO3-+H2O,反应中形成的化学键是___________(填化学键的类型)。用NaOH溶液吸收少量SO2的离子方程式为____________。
(4)已知:2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJ·mol-1
2NO2(g) △H=-113.0kJ·mol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJ·mol-1
2SO3(g) △H=-196.6kJ·mol-1
则NO2(g)+SO2(g)![]() SO3(g)+NO(g) △H=_______。
SO3(g)+NO(g) △H=_______。
(5)在固定体积的密闭容器中,使用某种催化剂,改变原料气配比[n0(NO2):n0(SO2)]进行多组实验(各次实验的温度可能相同,也可能不同),测定NO2的平衡转化率以[a(NO2)]。部分实验结果如图所示:
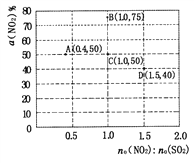
①如果要将图中C点的平衡状态改变为B点的平衡状态,应采取的措施是_________;
②若A点对应实验中,SO2(g)的起始浓度为c0 mol·L-1,经过t min达到平衡状态,该时段化学反应速率v(NO2)= ____mol·L·min-1;
③图中C、D两点对应的实验温度分别为Tc和Td,通过计算判断:Tc_____ Td (填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
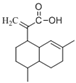
【题目】有机物X可作为合成青蒿素的一种基本原料,已知X的结构如下,下列有关X的说法正确的是
 ( )
( )
A. X为烃的含氧衍生物
B. X最多可以和3mol H2发生加成反应
C. X只能发生取代反应和加成反应
D. X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素的叙述正确的是( )
A. 金属元素与非金属元素能形成共价化合物
B. 只有在原子中,质子数才与核外电子数相等
C. 目前使用的元素周期表中,最长的周期含有36种元素
D. 非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉为主要原料合成-种具有果香味的物质C和化合物d的合成路线如下图所示。回答下列问题:

(1)B分子中的官能团名称为_______________。
(2)反应⑧的反应类型为_______________。
(3)反应③的化学方程式为_________________。反应⑤的化学方程式为___________________。
(4)反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是_______________。
(5)己知D的相对分子量为118,其中碳、氢两元素的质量分数分别为40.68%、5.08%,其余为氧元素,则D能发生酯化反应,且分子中只有两种不同化学环境的氢,则D的结构简式______________。
(6)请补充完整检验反应①淀粉水解程度的实验方案:取反应①的溶液2mL于试管中,_____________。
实验中可供选择的试剂:10%的NaOH溶液、新制Cu(OH)2悬浊液、碘水.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T五种,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是

A. 离子半径:Y<Z
B. 氢化物的稳定性:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z三种元素组成的常见化合物中含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com