
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________ ___。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c __0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)________c(Na+)(选填“>”、“<”或“=”)
从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______________________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。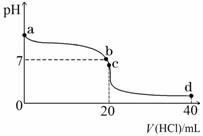
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
【答案】 I:(1) A-+H2O HA-+OH- D
HA-+OH- D
(2) > = (3) > c(A-)>c(Na+)>c(H+)>c(OH-)
Ⅱ:(1)NH3·H2O NH
NH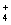 +OH– ;(2) NH4Cl NH3·H2O ;
+OH– ;(2) NH4Cl NH3·H2O ;
(3)c (Cl–) >c (NH4+)>c (H+)>c (OH–)
【解析】
试题分析:I:(1)某一元酸HA和NaOH溶液等体积混合后二者恰好完全反应产生盐NaA.该盐溶液显碱性,是因为该酸是弱酸,反应产生的盐水解破坏了水的电离平衡,最终使溶液中的c(OH-)>c(H+),用离子方程式表示为A-+H2O HA-+OH-;A.根据溶液中的电中性原则可知c(Na+)+c(H+)=c(OH-)+c(A-),正确;B.根据物料守恒可得c(Na+)=c(A-)(开始)=c(HA)+c(A-),正确;C.根据质子守恒可得c(HA)+c(H+)=c(OH-),正确;D.根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(A-),错误。(2)由于酸是弱酸,所以要使反应后溶液显中性,则应该使酸的物质的量稍微过量,因此②组情况表明,c>0.2mol/L. 根据电中性原则c(Na+)+c(H+)=c(OH-)+c(A-),由于溶液显中性,所以c(H+)=c(OH-)。故混合溶液中离子浓度c(A-)= c(Na+)。(3)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度;由于在该溶液中由于因为HA、NaA是等浓度混合的,因为c(H+)>c(OH-),说明HA的电离大于NaA的水解;所以c(A-)>c(Na+)。盐的电离作用远大于水的电离,所以c(Na+)>c(H+)。故离子浓度由大到小的顺序是 c(A-)>c(Na+)>c(H+)>c(OH-);Ⅱ:(1)氨水中的一水合氨是弱电解质,在溶液中存在电离平衡:NH3·H2O
HA-+OH-;A.根据溶液中的电中性原则可知c(Na+)+c(H+)=c(OH-)+c(A-),正确;B.根据物料守恒可得c(Na+)=c(A-)(开始)=c(HA)+c(A-),正确;C.根据质子守恒可得c(HA)+c(H+)=c(OH-),正确;D.根据电荷守恒可知c(Na+)+c(H+)=c(OH-)+c(A-),错误。(2)由于酸是弱酸,所以要使反应后溶液显中性,则应该使酸的物质的量稍微过量,因此②组情况表明,c>0.2mol/L. 根据电中性原则c(Na+)+c(H+)=c(OH-)+c(A-),由于溶液显中性,所以c(H+)=c(OH-)。故混合溶液中离子浓度c(A-)= c(Na+)。(3)从③组实验结果分析,说明HA的电离程度大于NaA的水解程度;由于在该溶液中由于因为HA、NaA是等浓度混合的,因为c(H+)>c(OH-),说明HA的电离大于NaA的水解;所以c(A-)>c(Na+)。盐的电离作用远大于水的电离,所以c(Na+)>c(H+)。故离子浓度由大到小的顺序是 c(A-)>c(Na+)>c(H+)>c(OH-);Ⅱ:(1)氨水中的一水合氨是弱电解质,在溶液中存在电离平衡:NH3·H2O NH
NH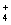 +OH– ;在b点时溶液呈中性,则在该点溶液中的溶质是NH4Cl和NH3·H2O ;(3)在c点所示溶液中,c(H+)>c(OH-),根据电荷守恒可知:c (Cl–) >c (NH4+)。盐的电离作用大于弱电解质的电离作用,所以c (NH4+)>c (H+)。故离子浓度从大到小的关系为c (Cl–) >c (NH4+)>c (H+)>c (OH–)。
+OH– ;在b点时溶液呈中性,则在该点溶液中的溶质是NH4Cl和NH3·H2O ;(3)在c点所示溶液中,c(H+)>c(OH-),根据电荷守恒可知:c (Cl–) >c (NH4+)。盐的电离作用大于弱电解质的电离作用,所以c (NH4+)>c (H+)。故离子浓度从大到小的关系为c (Cl–) >c (NH4+)>c (H+)>c (OH–)。
考点:考查弱电解质的电离、盐的水解、溶液中离子浓度的大小比较的知识。


科目:高中化学 来源: 题型:
某同学为了验证Fe3+是否能氧化H2SO3生成了SO42–,他用50mL0.1mol/LFeCl3溶液吸收制取SO2气体的尾气,再进行以下实验:
(1)检验吸收液中的SO42–: ,则证明Fe3+能把H2SO3氧化为SO42–。
(2)请配平并完成上述反应中的化学方程式:
2FeCl3+SO2+ ==2FeCl2+H2SO4+2HCl,反应中的氧化产物是 (写化学式)。
(3)吸收液中除了含有H+、Cl–、SO42–以外,对其它成份(Fe3+、Fe2+、H2SO3)的可能组合进行探究:
①提出假设。
假设1:溶液中存在Fe3+、Fe2+;
假设2:溶液中存在 ;
假设3:溶液中存在Fe2+ 而不存在H2SO3 (二者恰好完全反应)。
②设计方案、进行实验,验证假设。请在表中写出实验步骤以及预期现象和结论(可以不填满)。限选实验试剂和仪器:试管、滴管、0.1moL L-1KMnO4、0.1moL
L-1KMnO4、0.1moL L-1KSCN溶液、品红稀溶液。
L-1KSCN溶液、品红稀溶液。
| 实验步骤 | 预期现象和结论 |
| 步骤1:用试管取样品溶液2~3mL,再用滴管取 | 若出现血红色,则假设1成立;若未出现血红色,则假设2或假设3成立。 |
| 步骤2:
| 结合步骤1的现象和结论,
|
查看答案和解析>>
科目:高中化学 来源: 题型:
如右图所示,A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,不溶于硫酸、硝酸,却溶于氢氟酸。请填写以下空白。
(1)A、B、C、D的化学式分别是________、________、________、________。
(2)A→B的化学方程式是____________。
(3)C→D的离子方程式是____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
在下列各溶液中,离子一定能大量共存的是
A.强碱性溶液中: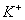 、
、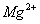 、
、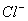 、
、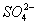
B.室温下,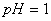 的盐酸中:
的盐酸中: 、
、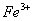 、
、 、
、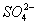
C.含有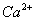 的溶液中:
的溶液中: 、
、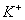 、
、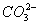 、
、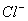
D.由水电离产生的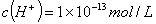 的溶液中:
的溶液中: 、
、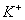 、
、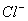 、
、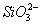
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为
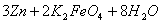

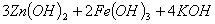
下列叙述不正确的是
A.充电时阳极反应为: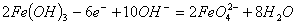
B.放电时负极反应为: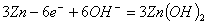
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关酸雨的说法正确的是( )
A.酸雨就是指PH<7的雨水
B.酸雨是因为雨水中含有CO2
C.工业上大量燃烧含有硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因
D.酸雨没有危害,所以不必担心,也不必想办法治理
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组元素中按微粒半径递增顺序排列的是( )
A. K、Na、Li B.Ba2+、Ca2+、Mg2+ C. N、O、F D. Ca2+、K+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g)
ΔH=+140.5 kJ·mol-1
C(s,石墨)+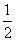 O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是 ( )。
A.+80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.-80.5 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com