
下列有关酸雨的说法正确的是( )
A.酸雨就是指PH<7的雨水
B.酸雨是因为雨水中含有CO2
C.工业上大量燃烧含有硫燃料和以含硫矿石为原料冶炼金属产生的SO2是产生硫酸型酸雨的主要原因
D.酸雨没有危害,所以不必担心,也不必想办法治理
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.用惰性电极电解 溶液分别得到单质
溶液分别得到单质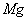 和Cl2
和Cl2
B.常温下,某溶液中由水电离出的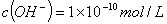 ,该溶液一定呈酸性
,该溶液一定呈酸性
C.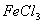 溶液和
溶液和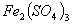 溶液加热蒸干、灼烧都得到
溶液加热蒸干、灼烧都得到
D.在AgBr饱和溶液中加入AgNO3溶液,达到平衡时,溶液中Br-浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
| 序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________ ___。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c __0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)________c(Na+)(选填“>”、“<”或“=”)
从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______________________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。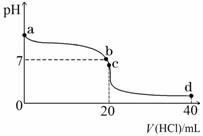
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
检验某晶体是否是铵盐时,将待检物取出少量放在试管中,接下来的操作是 ( )
A.加烧碱溶液,加热,用湿润的红色石蕊试纸放在管口检验
B.直接加热,用湿润的红色石蕊试纸放在管口检验
C.加烧碱溶液,加热,向试管中滴加紫色石蕊试液
D.加水溶解,滴加无色酚酞试液,看是否变红
查看答案和解析>>
科目:高中化学 来源: 题型:
现有下列物质:①Cl2 ②Na2O2 ③NaOH ④HCl ⑤H2O2 ⑥MgF2 ⑦NH4 Cl。
(1)只由离子键构成的物质是__________ (填序号,下同)
(2)只由共价键构成的物质是__________
(3)只由非金属元素组成的离子化合物是__________
(4)由离子键和共价键构成的物质是__________
(5)写出⑤H2O2的电子式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列热化学方程式分析,C(s)的燃烧热△H等于 ( )
C(s) + H2O(l) === CO(g) + H2(g); △H1 ==175.3kJ·mol—1
2CO(g) + O2(g) == 2CO2(g); △H2 == —566.0 kJ·mol—1
2H2(g) + O2(g) == 2H2O(l); △H3 == —571.6 kJ·mol—1
A. △H1 + △H2 —△H3 B.2△H1 + △H2 + △H3
C. △H1 + △H2/2 + △H3 D. △H1 + △H2/2 + △H3/2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com