
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:

(1)写出工业上制取Cl2的化学方程式_____________________________________。
(2)在“反应液I”中加入KOH固体的目的是①_________________,②提供碱性环境。
(3)写出Fe(NO3)3溶液与碱性KClO溶液反应的化学方程式:______________________。
(4)K2FeO4可作为新型多功能水处理剂的原因是:
①_____________________,②_________________________。
(5)从“反应液II”中分离出K2FeO4后,副产品是_________________(写化学式)。
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为_______mol。
【答案】2NaCl+2H2O![]() 2NaCl+Cl2↑+H2↑与反应液I中多余的Cl2反应2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2OK2FeO4强氧化剂,杀菌消毒还原产物Fe3+水解生成Fe(OH)3胶体净水KNO3 KCl15
2NaCl+Cl2↑+H2↑与反应液I中多余的Cl2反应2Fe(NO3)3+3KClO+10KOH=2K2FeO4+6KNO3+3KCl+5H2OK2FeO4强氧化剂,杀菌消毒还原产物Fe3+水解生成Fe(OH)3胶体净水KNO3 KCl15
【解析】
足量Cl2通入和KOH溶液中,温度低时发生反应Cl2+2OH-=Cl-+ClO-+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4。
(1)工业是利用电解饱和食盐水制取氯气。反应方程式为:2NaCl+2H2O![]() 2NaCl+Cl2↑+H2↑;
2NaCl+Cl2↑+H2↑;
(2)由工艺流程可以知道,反应液I中有过量的Cl2反应,加KOH固体的目的是与过量的Cl2继续反应生成KClO;
(3)根据分析可以知道,Fe(NO3)3溶液与碱性KClO溶液反应生成高铁酸钾和氯化钾,反应的化学方程式为2Fe(NO3)3+3KClO+10KOH=2K2FeO4+3KCl+6KNO3+5H2O;
(4)K2FeO4具有强氧化性,可杀菌消毒,同时被还原形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀,所以K2FeO4可作为新型多功能水处理剂的原因是①K2FeO4具有强氧化性,可杀菌消毒;②还原产物Fe元素为+3价,在水中形成Fe(OH)3胶体,可吸附水中悬浮物形成沉淀;
(5)由工艺流程及③可以知道,从“反应液II”中分离出K2FeO4后,会有副产品KNO3、KCl;
(6)根据反应Cl2+2OH-=Cl-+ClO-+H2O和2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,可得关系式2K2FeO4~3Cl2,1.98kgK2FeO4的物质的量为10mol,根据关系式可以知道氯气的物质的量为15mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室制取氨气通常有两种方法:
①用固体氢氧化钙与氯化铵共热;
②在常温下用固体氢氧化钠与浓氨水反应。

(1)上面的制取装置图中,方法①应选用装置__________(填“A”或“B”,下同);方法②应选用装置__________。
(2)加热氯化铵与氢氧化钙混合物制取氨气的反应方程式是________________。
(3)在制取后,如果要干燥氨气,应选用的干燥剂是________________(填字母)。
A.浓硫酸 B.碱石灰 C.五氧化二磷
(4)检验集气瓶中是否收集满氨气的方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
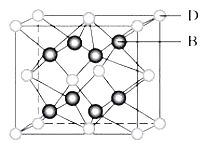
【题目】有A、B、C、D、E、F六种元素,A是周期表中原子半径最小的元素,B是电负性最大的元素,C的2p轨道中有三个未成对的单电子,F原子核外电子数是B与C核外电子数之和,D是主族元素且与E同周期,E正一价阳离子M能层电子已排满。D与B可形成离子化合物其晶胞结构如图所示。请回答下列问题:
(1)E元素原子基态时的价电子排布图为___________;
(2)A2F分子中F原子的杂化类型是_______,F的氧化物FO3分子空间构型为______;
(3)CA3极易溶于水,其原因主要是________,试判断CA3溶于水后形成CA3·H2O的合理结构________(填字母代号),从氢键的形成角度回答推理依据是:___________。
(a)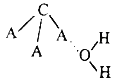 (b)
(b)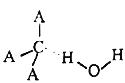
(4)E的晶胞常采取________堆积方式。
(5)从图中可以看出,D跟B形成的离子化合物的化学式为_________;该离子化合物晶体的密度为ag/cm3,则晶胞的体积是_______cm3(写出表达式即可,NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Se、Br两种元素的部分信息如图所示,下列说法正确的是
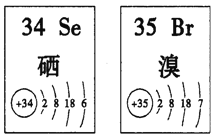
A. 原子半径:Br>Se>P B. 还原性:S2->Se2->Br-
C. SeO2既有氧化性又有还原性 D. 在Se2Br2分子中只含有极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为______,D 的化学名称为______。
(2)①和③的反应类型分别为______、______。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气_______mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为_____________________________________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3:1,写出其中3种的结构简式_______________________________。
(6)写出用2苯基乙醇为原料(其他无机试剂任选)制备化合物D的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液能与铝作用生成H2,则溶液中一定可以大量共存的离子组是
A. Cl-、Ba2+、Mg2+、ClO- B. Cl-、SO42-、Cu2+、Mg2+
C. Cl-、SO42-、K+、Na+ D. HCO3-、NO3-、Na+、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中横坐标为加入反应物的物质的量,纵坐标为产生沉淀的物质的量.下列选项编号对应的曲线编号错误的是

A. 向NaAlO2溶液中逐渐滴入HCl至过量
B. 向澄清石灰水中通入SO2至过量
C. 向含有盐酸的AlCl3溶液中滴入NaOH溶液至过量
D. 向含有等物质的量的Ca(OH)2、KOH的混合溶液中通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是( )

选项 | 假设 | 结论 |
A | 甲为Al(OH)3 | 丁可能是盐酸 |
B | 甲为Na2CO3溶液 | 戊可能是CO2 |
C | 甲为Fe | 丁可能是盐酸 |
D | 甲为N2 | 戊可能是氧气 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3、Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如下:
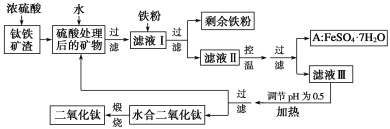
请回答下列问题:
(1)硫酸与二氧化钛反应的化学方程式是______________________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________、_______________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:_________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_____________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、______(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56a kg A(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36b kg A和1.12c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶质只有硫酸钾和硫酸铁,则理论上可生产红色颜料__________ kg。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com