
【题目】现对三种不同的镁铝合金样品进行编号,做以下实验探究。
(1)取样品①m1g,加入过量NaOH溶液,充分反应后过滤;往滤液中通入过量CO2气体:将所得沉淀过滤、洗涤、烘干,灼烧,得到固体的质量仍然为m1g.合金中镁的质量分数为_____(保留2位小数,下同)。
(2)取样品②m2g,与足量稀硫酸反应,固体完全溶解时得到气体的体积为VL(标准状况)。m2的取值范围是_____。
(3)取样品③0.918g与30.00mL、2.00mL盐酸充分反应后,得到672mL气体(标准状况)。剩余合金0.306g(认为合金中镁、铝与酸的反应同时发生)。然后在反应后所得体系中继续加1.00mol/L的NaOH溶液,恰好使所有铝元素均不以沉淀形式存在。则需要加入1.00mol/L的NaOH溶液_____mL。
【答案】0.47 0.80V<m2<1.07V 78.00
【解析】
(1)镁铝合金样品,加入过量NaOH溶液,充分反应后过滤;往滤液中通入过量CO2气体:将所得沉淀过滤、洗涤、烘干,灼烧,得到的固体是氧化铝。
(2)镁铝合金样品,与足量稀硫酸反应,镁、铝都能与硫酸反应生成氢气,利用极值法计算m2的取值范围;
(3)镁铝合金样品,(0.918-0.306)g与30.00mL 2.00mol/L盐酸充分反应后,得到672mL气体,可计算出样品③中镁铝的含量;使所有铝元素均不以沉淀形式存在时,溶质恰好是氯化钠和偏铝酸钠。
(1)镁铝合金样品,加入过量NaOH溶液,充分反应后过滤;往滤液中通入过量CO2气体:将所得沉淀过滤、洗涤、烘干,灼烧,得到的固体是氧化铝,即Al2O3的质量与镁铝合金样品质量相等,根据元素守恒,Al2O3中氧元素的质量等于样品中Mg的质量,合金中镁的质量分数为![]() =0.47;
=0.47;
(2)生成氢气的物质的量是![]() ;假设m2g样品全是Mg,Mg+H2SO4= MgSO4+H2;则Mg的物质的量是
;假设m2g样品全是Mg,Mg+H2SO4= MgSO4+H2;则Mg的物质的量是![]() ,质量是
,质量是![]() 1.07V;假设m2g样品全是Al,2Al+3H2SO4= Al2(SO4)3+3H2;则Al的物质的量是
1.07V;假设m2g样品全是Al,2Al+3H2SO4= Al2(SO4)3+3H2;则Al的物质的量是![]() ,质量是
,质量是![]() 0.80V;所以m2的取值范围是0.80V<m2<1.07V;
0.80V;所以m2的取值范围是0.80V<m2<1.07V;
(3)设与盐酸反应的镁、铝的物质的量分别是xmol、ymol;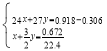 ,解得
,解得![]() ;即镁、铝的物质的量比为1:1,0.918g样品中铝的物质的量是0.018mol;使所有铝元素均不以沉淀形式存在时,溶质恰好是氯化钠和偏铝酸钠,根据氯元素守恒,氯化钠的物质的量是 0.03L× 2.00mol/L=0.06mol,根据铝元素守恒,偏铝酸钠的物质的量是0.018mol,则需要氢氧化钠的物质的量是0.018mol+0.06mol=0.078mol,需要加入1.00mol/L的NaOH溶液的体积是
;即镁、铝的物质的量比为1:1,0.918g样品中铝的物质的量是0.018mol;使所有铝元素均不以沉淀形式存在时,溶质恰好是氯化钠和偏铝酸钠,根据氯元素守恒,氯化钠的物质的量是 0.03L× 2.00mol/L=0.06mol,根据铝元素守恒,偏铝酸钠的物质的量是0.018mol,则需要氢氧化钠的物质的量是0.018mol+0.06mol=0.078mol,需要加入1.00mol/L的NaOH溶液的体积是![]() 0.078L=78.00 mL。
0.078L=78.00 mL。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】化合物F是一种药物中间体,可以通过以下方法合成:
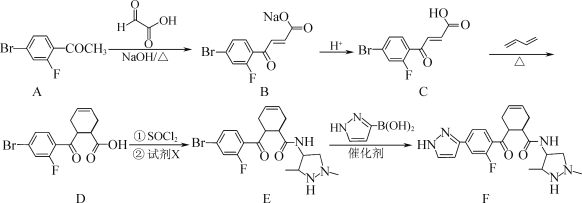
(1)C中的含氧官能团名称为________和________。
(2)E![]() F的反应类型为________。
F的反应类型为________。
(3)试剂X的分子式为C5H13N3,写出X的结构简式:________。
(4)A的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;② 分子中只有4种不同化学环境的氢。
(5)写出以CH3CH=CHCH3、HCHO及CH3COCH3为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)被称为21世纪金属,在航海、航空、记忆和涂料方面应用广泛,TiO2是一种优良的光催化剂。20世纪科学家尝试用多种方法将金红石(TiO2)还原,发现金红石直接氯化是冶炼钛的关键。
步骤:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g) ΔH=+1493kJmol-1,ΔS=+61JK-1mol-1
该反应发生温度高达2170℃,能耗大,对设备和生产要求几乎达到苛刻程度。目前科学家采用金红石加碳氯化方法,在较温和条件下成功制取TiCl4,为人类快速迈进钛合金时代做出了巨大贡献。金红石加碳氯化的主要反应如下:
反应Ⅰ:TiO2(s)+2Cl2(g) +C(s)![]() TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
TiCl4(g)+CO2(g) ΔH1,ΔS1=+64JK-1mol-1
反应Ⅱ:TiO2(s)+2Cl2(g) +2C(s)![]() TiCl4(g)+2CO(g) ΔH2,△S2
TiCl4(g)+2CO(g) ΔH2,△S2
已知:①C(s)+O2(g)=CO2(g) ΔH=-394.3kJmol-1
②2C(s)+O2(g)=2CO(g) ΔH=-222.3kJmol-1
请回答:
(1)反应Ⅰ的ΔH1=__kJmol-1。
(2)对于气体参加的反应,表示平衡常数KP时,用气体组分B的平衡压强P(B)代替该气体物质的量浓度c(B),则反应Ⅰ的KP=__(用表达式表示)。
(3)在常温、常压、光照条件下,N2在催化剂TiO2表面与H2O发生反应,2N2(g)+6H2O(1)=4NH3(g)+3O2(g) ΔH=+1530.4kJmol-1
进一步研究相同条件下NH3生成量与温度的关系,部分实验数据见表:
实验组别 | 1 | 2 | 3 | 4 |
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
O2生成量/(10-6mol) | 3.6 | 4.4 | 4.5 | 1.5 |
反应时间/h | 3 | 3 | 3 | 3 |
容器体积/L | 2 | 2 | 2 | 2 |
①请在如图中画出上述反应在“有催化剂”与“无催化剂”两种情况下反应过程中体系能量随反应过程的变化趋势示意图(图中标明必要的文字说明)。___
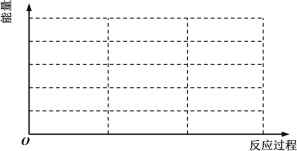
②根据表中数据,在303K时,在3h内用氮气表示其平均反应速率为___molL-1h-1。判断组别4中反应是否达到平衡状态___(填“是”或“否”),并说明理由___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是

A. A是可与草木灰混合使用的肥料 B. C可用排空气法收集
C. F和B能发生复分解反应生成盐 D. B在一定条件下可直接与Y反应生成D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5mol CH4的质量是_____g,在标准状况下的体积为______L;含有约______个氢原子。
(2)将标准状况下22.4L的HCl溶于水配成200mL的溶液,所得溶液的物质的量浓度为______;配制300mL 0.5molL﹣1氯化钠溶液,需要1.5molL﹣1的氯化钠溶液的体积是______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)第四周期元素中价层成对电子数与基态Mg价层成对电子数相等的元素有_________种。
(2)吡咯(平面形结构,结构式为![]() ),N原子杂化方式为______。多原子分子中的大π键可用符号
),N原子杂化方式为______。多原子分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为_______。
(3)一种锰的氧化物的晶胞如图甲,请写出该氧化物的化学式______。若沿z轴方向观察该晶胞,可得投影图如图乙,请画出沿y轴方向的投影图______。
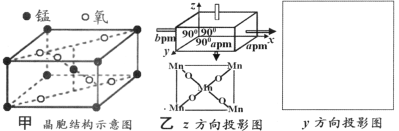
(4)某含Mg储氢晶体储氢后转化为MgH2,MgH2晶体的结构如图丙,晶胞参数a=b=450pm,c=301pm,原子分数坐标为A(0,0,0)、B(0.305,0.305,0)、C(1,1,1)、D(0.195,0.805,0.5)。
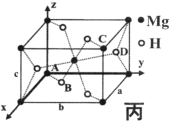
①该晶体中Mg的配位数是__________。
②Mg2+的半径为72pm,则H-的半径为____________pm(列出计算表达式)
③用NA表示阿伏伽德罗常数,则MgH2晶体中氢的密度是标准状况下氢气密度的_______倍(列出计算表达式,氢气密度为0.089g·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M的结构结构简式如图所示。关于M,下列说法正确的是( )
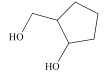
A.分子中所有碳原子可能共平面
B.M的同分异构体中,能与饱和NaHCO3溶液反应有9种
C.可使酸性高锰酸钾溶液褪色
D.1molM与足量的钠反应可以生成22.4LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]()
![]() N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
N2(g)+CO2(g);ΔH= -373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】amol FeS与bmol FeO投入到VL、c mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
( )
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④![]() mol
mol
A.①④B.②③C.①③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com