
【题目】工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应的化学方程式为______,若将4mol氯气通入足量的石灰乳中,理论上可得到次氯酸钙多少克?________
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol/L的下列溶液:
①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___________________________。
(2)④、⑤、⑦、⑧四种溶液中NH4+浓度由大到小的顺序是(填序号)________ 。
(3)将②、③混合后,若溶液呈中性,则消耗两溶液的体积为 ② ________ ③(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为______________________________
(4)常温下将0.010 mol CH3COONa和0.004 mol HCl溶于水,配制成0.5 L混合溶液,判断:
①其中有两种粒子的物质的量之和一定等于0.010 mol,它们是________和________。
②溶液中c(CH3COO-)+n(OH-)-n(H+)=________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N具有镇痛、消炎等药理作用,其合成路线如下:
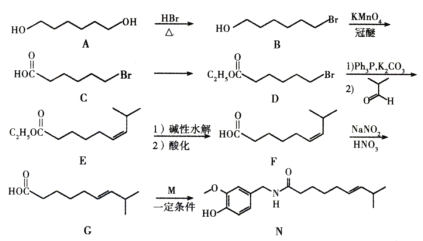
(1)A的系统命名为____________,E中官能团的名称为_____________。
(2)A→B的反应类型为____________,从反应所得液态有机混合物中提纯B的常用方法为_____________。
(3)C→D的的化学方程式为_____________。
(4)C的同分异构体W(不考虑手性异构)可发生银镜反应;且1 mol W最多与2 mol NaOH发生反应,产物之一可被氧化成二元醛。满足上述条件的W有____________种,若W的核磁共振氢谱具有四组峰,则其结构简式为_____________。
(5)参照上述合成路线,以![]() 为原料,采用如下方法制备医药中间体
为原料,采用如下方法制备医药中间体![]() 。
。
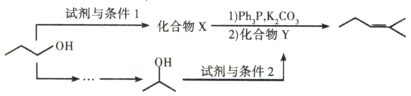
该路线中试剂条件1为____________,X的结构简式为____________;试剂与条件2为____________,Y的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由 W、X、Y、Z 四种短周期元素组成,其中 W、Y、Z 分别位于三个不同周期,Y 核外最外层电子数是 W 核外最外层电子数的二倍;W、X、Y 三种简单离子的核外电子排布相同。下列说法不正确的是

A.原子半径:W < X < Y < Z
B.X 与 Y、Y 与 Z 均可形成具有漂白性的化合物
C.简单离子的氧化性: W X
D.W 与 X 的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不是氧化还原反应的是 ( )
①H2+Cl2![]() 2HCl
2HCl
②Na2CO3+2HCl=2NaCl+H2O+CO2↑
③2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
④CuO+2HNO3=Cu(NO3)2+H2O
⑤2HgO![]() 2Hg+O2↑
2Hg+O2↑
A.②④B.①③C.①②③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有X、Y、Z三种元素,已知有如下情况:
①X、Y、Z的单质在常温下均为气体。
②X的单质在Z的单质中燃烧,生成XZ,燃烧时火焰呈苍白色。
③XZ极易溶于水,在水溶液中电离出X+和Z-。XZ的水溶液可使石蕊试液变红。
④两分子X的单质可与一分子Y的单质化合生成两分子X2Y,X2Y常温下为液体。
⑤Z的单质溶于X2Y中,所得溶液具有漂白作用。
请完成下列问题:
(1)请写出Z-的的离子结构示意图_____________。
(2)请写出Z单质溶于X2Y中发生反应的化学方程式_____________。
(3)请写出Z单质与NaOH反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法错误的是( )
A.乙烯、聚氯乙烯和苯中均含有碳碳双键
B.植物油含不饱和高级脂肪酸酯,能使![]() 的
的![]() 溶液褪色
溶液褪色
C.乙酸乙酯中混有的少量乙酸,可用饱和![]() 溶液除去
溶液除去
D.用酒精消毒,其原理是酒精使细菌中的蛋白质变性而失去生理活性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双极膜由阳离子交换膜、催化剂层和阴离子交换膜组合而成,在直流电场作用下可将水解离,在双极膜的两侧分别得到H+和OH-,将其与阳离子交换膜(阳膜)、阴离子交换膜(阴膜)组合,可有多种应用。
(1)海水淡化:模拟海水淡化,双极膜组合电解装置示意图如下。

①X极是______极(填“阴”或“阳”)。
②电解后可获得较浓的盐酸和较浓的NaOH溶液,上图中双极膜的右侧得到的是______(填“H+”或“OH-”)。
(2)钠碱循环法脱除烟气中的SO2,并回收SO2:
用pH>8的Na2SO3溶液作吸收液,脱除烟气中的SO2,至pH<6时,吸收液的主要成分为NaHSO3,需再生。
Ⅰ.加热pH<6时的吸收液使其分解,回收SO2并再生吸收液。所得的再生吸收液对SO2的吸收率降低,结合离子方程式解释原因:______。
Ⅱ.双极膜和阴膜组合电渗析法处理pH<6时的吸收液,可直接获得再生吸收液和含较高浓度HSO3的溶液,装置示意图如下。

①再生吸收液从______室流出(填“A”或“B”)。
②简述含较高浓度HSO3的溶液的生成原理:______。
③与Ⅰ中的方法相比,Ⅱ中的优点是______(列出2条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com