
【题目】某实验小组学生用50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
【答案】B
【解析】
A.根据实验过程的保温情况确定保温效果;
B.根据量热计的构造来判断该装置的缺少仪器;
C.中和热测定实验成败的关键是保温工作,烧杯间填满碎纸条的作用是保温;
D.中和热是强酸和强碱反应生成1mol水时放出的热量,与酸碱的用量无关。
A.该装置的保温效果并不如量热计那样好,肯定存在热量的散失,故A错误;
B.根据量热计的构造可以知道该装置的缺少仪器是环形玻璃搅拌器,所以B选项是正确的;
C.中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故C错误;
D.因为中和热是指酸跟碱发生中和反应生成1mol水所放出的热量,与酸碱的用量无关,中和热数值相等,故D错误。
所以B选项是正确的。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应X+Y![]() Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则关于X、Y、Z、W四种物质的聚集状态说法正确的是( )

A.X、Y均为气体,Z、W中有一种为气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.Z、W均为气体,X、Y中有一种是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子核外有_____个电子。
(2)能作为溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是_____(填序号)。
a.IBr中溴为﹣1价 b.HBr、HI的酸性 c.HBr、HI的热稳定性 d.Br2、I2的熔点
(3)海水提溴过程中,先向浓缩海水中通入_____,将其中的Br氧化,再用“空气吹出法”吹出Br2,并用纯碱吸收。Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),则吸收1molBr2,转移电子_____mol,反应中氧化产物为_____。
(4)已知:AlF3的熔点为1040℃,AlCl3在178℃升华。从物质结构的角度解释两者熔点相差较大的原因:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双一(对烷氧基苯甲酸)-2,3一二氯—1,4—苯二酚酯(G)是一种新的液晶化合物,在液晶显示领域里有广泛的应用,其合成路线如下:

已知:R为烷烃基,D的核磁共振氢谱为四组峰,且峰面积之比为9:2:2:1。
回答下列问题:
(1)A的结构简式为______________________________。
(2)B的化学名称为_________________________。
(3)A与B生成C的化学方程式为_____________________________。
(4)由E生成G的反应类型为______________________。
(5)G的分子式为______________________。
(6)H是D的同分异构体,H的苯环上只有两个对位的取代基,H可与FeCl3溶液发生显色反应,且能发生水解反应和银镜反应,则H共有______种;其中核磁共振氢谱为六组峰,且峰面积之比为1:2:6:2:2:1的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C △H <0,分两步进行 ① A+B→X △H>0 ② X→C △H<0 。下列示意图中,能正确表示总反应过程中能量变化的是
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知:2NO2(g)![]() N2O4(g))
N2O4(g))
C.煅烧粉碎的硫铁矿利于SO2的生成
D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3 molH2。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如图。
CH3OH(g)+H2O(g) ΔH=-49.0kJ·mol-1。T1温度下,测得CO2和CH3OH(g)的浓度随时间变化如图。

请回答:
(1)从反应开始到平衡,氢气的反应速率v(H2)=____。
(2)能够说明该反应已达到平衡的是____(填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3 molH2的同时生成1molCH3OH
(3)下列措施中能使平衡混合物中n(CH3OH)/n(CO2)增大的是_____。
A.加入催化剂
B.充入He(g),使压强增大
C.将H2O(g)从体系中分离
D.降低温度
(4)求此温度(T1)下该反应的平衡常数K1=____(计算结果保留三位有效数字)。
Ⅱ.下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积 | 1×10-14 | a | 1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则a___(填“>”“<”或“=”)1×10-14,作出此判断的理由是_____。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol·L-1,则c(OH-)为___。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6mol·L-1,该溶液中c(H+)=___mol·L-1,c(OH-)=___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烃A中碳、氢元素质量比为24:5,D与含NaOH的Cu(OH)2悬浊液在加热条件下反应并得到砖红色沉淀,F为具有浓郁香味、不易溶于水的油状液体,且RCl+NaOH![]() ROH+NaCl,其转化关系如图所示:
ROH+NaCl,其转化关系如图所示:
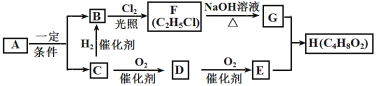
请回答:
(1)E中官能团的名称______。
(2)C→B的反应类型_______。
(3)D→E的化学方程式是______。
(4)H与NaOH溶液反应的方程式_______。
(5)下列说法不正确的是_______。
A.工业上通过石油裂解可实现A→B+C
B.利用植物秸秆在一定条件下通过水解反应可以直接得到有机物G
C.可用Na2CO3溶液鉴别D、G
D.完全燃烧等物质的量的C、D、E消耗O2的量依次减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com