
【题目】下列措施或事实不能用勒夏特列原理解释的是( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知:2NO2(g)![]() N2O4(g))
N2O4(g))
C.煅烧粉碎的硫铁矿利于SO2的生成
D.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的离子方程式:
(1)实验室制取氢气常用的药品是锌和稀硫酸,反应的离子方程式为__,还可用稀盐酸代替稀硫酸,用铁代替锌,反应的离子方程式表示为__。
(2)实验室用碳酸钙与盐酸反应制取二氧化碳气体,反应的离子方程式是__,常用澄清石灰水检验二氧化碳气体的离子方程式是__。
(3)通常用饱和小苏打溶液除去二氧化碳中的氯化氢,反应的离子方程式为__,不能用氢氧化钠溶液的原因是__(用离子方程式表示原因,下同),也不能用碳酸钠溶液的原因是__。
(4)将表面附有铁锈(成分是Fe2O3)的铁钉放入稀硫酸中,一开始溶液由无色变成黄色,此时反应的离子方程式是__,很快溶液又由黄色变成浅绿色,用离子反应方程式表示这个颜色变化:__,最后又可观察到有气体产生,其离子方程式是__。
(5)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为__;②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生用50 mL 0.50 mol·L1盐酸与50 mL 0.55 mol·L1 NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中放出的热量计算中和热。下列说法正确的是

A. 实验过程中没有热量损失
B. 图中实验装置缺少环形玻璃搅拌棒
C. 烧杯间填满碎泡沫塑料的作用是固定小烧杯
D. 酸或碱的物质的量越大,所测中和热的数值越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科技工作者提出的一种OER(氧气析出反应) 机理如图所示下列说法错误的是
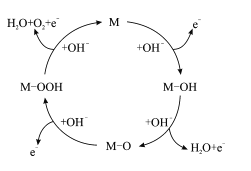
A.物质M不能改变OER反应的趋势
B.每一步反应过程都是氧化还原反应
C.反应过程中只涉及极性键的断裂和形成
D.该总反应方程式为4OH--4e-![]() 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25℃、1.01×105Pa时,16g S粉在足量的氧气中充分燃烧生成二氧化硫气体,放出148.5kJ的热量,则S的燃烧热的热化学方程式为:___。
(2)1L1mol/L稀盐酸跟1L1mol/LNaOH溶液起中和反应放出57.3kJ热量,其热化学方程式为:___。
(3)已知如图所示的可逆反应:

①A(g)+B(g)![]() 2C(g) +D(g);ΔH=QkJ/mol则Q___0(填“>”、“<”或“=”)
2C(g) +D(g);ΔH=QkJ/mol则Q___0(填“>”、“<”或“=”)
②反应体系中加入催化剂,反应速率增大,则E1的变化是:E1___,ΔH的变化是:ΔH___(填“增大”“减小”“不变”)。
(4)发射卫星用N2H4作燃料,NO2作氧化剂,两者反应生成N2和水蒸气,
已知:N2(g)+2O2(g)=2NO2(g) △H1=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2=-534kJ/mol
则1mol气体肼和NO2完全反应时的反应热△H=___kJ/mol。
(5)已知反应A放出热量Q1kJ,焓变为△H1,反应B放出热量Q2kJ,焓变为△H2,若Q1>Q2,则△H1___△H2
(6)1molC与1molH2O(g)反应生成1molCO(g)和1molH2(g),需吸收131.5kJ的热量,该反应的反应热为△H=___kJ/mol;
(7)反应A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15mol/(Ls) ②v(B)=0.6mol/(Ls)
③v(C)=0.4mol/(Ls) ④v(D)=0.45mol(Ls)
则该反应进行最快的为___(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物既是一种资源,也会给环境造成危害。
I.氨气是一种重要的化工原料。
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)![]() (NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
(NH2)2CO(s)+H2O(g),ΔH= -x KJ/mol (x>0),其他相关数据如表:
物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
则表中z(用x a b d表示)的大小为________。
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图所示,该反应到达平衡时CO2的平均反应速率为_____, 此温度时的平衡常数为_____。

下列能使正反应的化学反应速率加快的措施有___________.
① 及时分离出尿素 ② 升高温度 ③ 向密闭定容容器中再充入CO2 ④ 降低温度
Ⅱ.氮的氧化物会污染环境。目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质。某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体)。

(l)写出装置⑤中反应的化学方程式_________。
(2)装置①和装置②如下图,仪器A的名称为_____,其中盛放的药品名称为_______。

装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是________。
(3)装置⑥中,小段玻璃管的作用是______;装置⑦的作用是除去NO, NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。
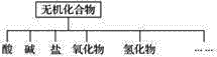
(1)上图所示的物质分类方法名称是____________。
(2)以钠、钾、氢、氧、碳、硫、氮中任两种或三种元素组成合适的物质,分别填在下表中的横线上:
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①HCl ②____ | ③____ ④Ba(OH)2 | ⑤Na2CO3 ⑥____ | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(3)写出⑦转化为⑤的化学方程式__________。
(4)写出实验室由⑩制备氧气的化学方程式______。
(5)实验室制备⑦常用________和________反应,检验该气体的方法是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com