
【题目】物质间的转化需要考虑反应实质、条件以及物质的用量,下列物质转化在给定条件下能实现的是( )
①![]()
②![]()
③![]()
![]()
![]()
④NaCl溶液![]() NaCl晶体
NaCl晶体![]()
![]()
⑤![]()
![]()
![]()
⑥![]()
![]() 漂白粉
漂白粉
A.①②③B.②③C.①④⑤⑥D.②④⑤⑥
【答案】D
【解析】
①硅和氧气反应生成二氧化硅,二氧化硅难溶于水,不能与水反应,①错误;
②硫和氧气反应生成二氧化硫,二氧化硫被过氧化氢氧化:SO2+H2O2=H2SO4,生成硫酸,②正确;
③在高温条件下,碳和二氧化硅反应生成硅和一氧化碳,化学反应方程式为:2C+SiO2![]() Si+2CO↑,③错误;
Si+2CO↑,③错误;
④氯化钠的溶解度受温度影响较小,氯化钠溶液蒸发结晶得到氯化钠固体,电解熔融的氯化钠可以生成钠,反应的化学方程式为2NaCl(熔融)![]() 2Na+Cl2↑,生成钠单质,④正确;
2Na+Cl2↑,生成钠单质,④正确;
⑤钠和氧气常温反应生成氧化钠:4Na+O2=2Na2O,氧化钠和水反应生成氢氧化钠:Na2O +H2O=2NaOH,⑤正确;
⑥氯化氢和氯酸钾发生氧化还原反应KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,生成氯气,氯气和石灰乳反应生成氯化钙次氯酸钙和水,该反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,因此可以用氯气和石灰乳反应制备漂白粉,⑥正确;
综上所述可知说法合理的是②④⑤⑥,答案选D。


科目:高中化学 来源: 题型:
【题目】离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为:6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件末给出)。
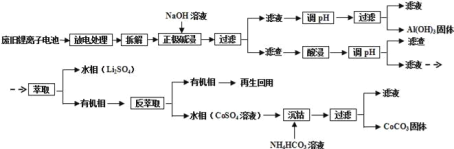
(1) LiCoO2中,Co元素的化合价为____________。
(2)写出“正极碱浸”中发生反应的离子方程式_____________________________________。
(3)采用H2SO4和H2O2的混合液进行“酸浸”,一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式:__________________________________________。可用盐酸代替H2SO4和H2O2的混合液,但缺点是___________________________。
(4)写出“沉钴“过程中发生反应的化学方程式_________________________________。
(5)充放电过程中,发生LiCoO2与LixCoO2之同的转化,写出放电时电池反应方程式_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I2在KI溶液中存在下列平衡:I2(aq)+I (aq)![]() (aq)。该反应的化学平衡常数K 随着温度的升高而减小。下列说法正确的是( )
(aq)。该反应的化学平衡常数K 随着温度的升高而减小。下列说法正确的是( )
A.反应 I2(aq)+I (aq)![]() (aq)的 ΔH>0
(aq)的 ΔH>0
B.利用上述反应,可以在碘量法滴定过程中加入过量 KI 以减少 I2 的挥发损失
C.在 I2 的 KI 溶液中加入CCl4,平衡不移动
D.一定温度下,向 I2 的KI 溶液中加入少量 KI 固体,化学平衡正向移动,平衡常数K 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为:铝土矿![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3![]() 无水AlCl3
无水AlCl3![]() Al
Al
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L1的HA溶液中逐滴加入0.1mol·L1的NaOH溶液,溶液中水所电离的c水(H+)随加入NaOH溶液体积的变化如图所示,下列说法正确的是
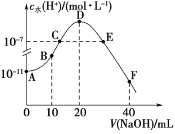
A.HA的电离常数Ka约为1×105
B.B点的溶液中粒子浓度满足关系:c(HA)>c(Na+)>c(A)
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度满足关系c(OH)=c(HA)+c(A)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学实验事实及其解释都正确的是( )
A. 过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜 可直接与1 mol/L稀硫酸反应
B. 粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
C. 铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面 形成了一层致密稳定的氧化膜
D. 工业制玻璃的主要反应之一:Na2CO3+SiO2高温Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随Cr含量的变化三种稀酸对Fe﹣Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
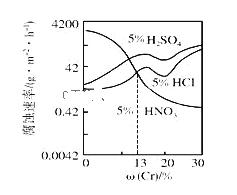
A.稀硝酸对Fe﹣Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.随着Cr含量增加,稀硝酸对Fe﹣Cr合金的腐蚀性减弱
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe﹣Cr合金的腐蚀性最强
D.酸对Fe﹣Cr合金的腐蚀与阴离子浓度无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X 和气体 Y 各 0.16mol 充入 ![]() 恒容密闭容器中,发生反应:
恒容密闭容器中,发生反应:![]()
![]() ,一段时间后达到平衡。反应过程中测定的数据如下表:
,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前 ![]() 的平均速率
的平均速率 ![]()
B.该温度下此反应的平衡常数 ![]()
C.其他条件不变,再充入 ![]() Z ,平衡时 X 的体积分数不变
Z ,平衡时 X 的体积分数不变
D.其他条件不变,降低温度,反应达到新平衡前 v(逆)> v(正)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com