
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
【答案】2 Fe3++SO2+2H2O="2" Fe2++SO42-+4H+ 过滤 沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次 FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O c 76%
【解析】
(1)根据方程式4Fe2++O2+ 4H+=4Fe3++2H2O和题干信息、可知,另一个反应的离子方程式为2 Fe3++SO2+2H2O="2" Fe2++SO42-+4H+,故答案为:2 Fe3++SO2+2H2O="2" Fe2++SO42-+4H+;
(2)①根据流程图可知,操作Ⅰ是过滤;洗涤的具体操作方法为:沿玻璃棒往漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复2一3次,故答案为:过滤;沿玻璃棒往漏斗中加入适量蒸馏水至浸没沉淀,让蒸馏水自然流下,重复2-3次;
②根据题给的信息,化学方程式为: FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O,故答案为:FeSO4+2NH4HCO3=FeCO3↓+(NH4)2SO4+CO2↑+H2O;
(3)①由于高锰酸钾溶液具有强氧化性,盐酸在常温下即可被其氧化,故一般用稀硫酸酸化,所以答案选c(硝酸不论稀、浓均具有强氧化性),故答案为:c;
②根据反应5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,可知样品中FeO的质量为0. 02 L×0. 01 mol/L×5×72 g/mol×10="0." 72 g,所以产品中Fe2O3的质量分数为((3. 0 g-0. 72 g)/3. 0 g×100%= 76%,故答案为:76%。


科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯(![]() )常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
)常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。
(1)肉桂酸甲酯中含氧官能团的名称是_________
(2)下列有关肉桂酸甲酯的叙述中,正确的是_________(填字母);
A.不能与溴的四氯化碳溶液发生加成反应
B.可以使酸性高锰酸钾溶液褪色
C.在碱性条件下能发生水解反应
D.难以发生加聚反应
(3)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。则G的结构简式为_________

(4)用芳香烃A为原料合成G的路线如下:
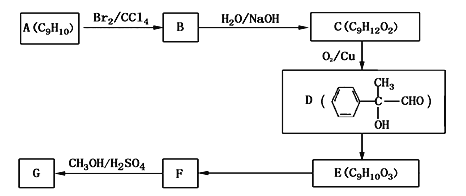
①A的结构简式________
②E→F的反应类型是_______
③C→D的化学方程式为__________________
④写出符合下列条件的F的同分异构体的结构简式__________
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1mol该物质与足量银氨溶液充分反应,生成4mol银单质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着社会经济的发展,汽车已进入千家万户,它给人们出行带来方便的同时汽车尾气污染问题也日益突显,汽车尾气中含![]() 和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:
和固体悬浮颗粒等。用活性炭还原处理氮氧化物是一种实用的氮氧化物转化方法:![]() ,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
,可实现氮氧化物无害转化。关于该反应下列说法不正确的是( )
A.升高温度能够加快反应速率
B.降低NO浓度能够减慢反应速率
C.使用合适的催化剂可以加快反应速率
D.加入足量的炭粉可以使![]() 转化
转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
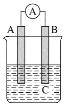
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Ag,B是Fe,C为稀AgNO3溶液
D.A是Fe,B是Ag,C为稀AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面所示是实验室制取SO2,并验证SO2的某些性质的装置图。试回答:
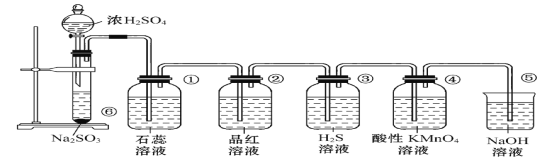
(1)②可证明SO2有___性;③可证明SO2有___性。
(2)④中的实验现象是__,证明SO2有___性。
(3)⑤的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2AB(g)![]() A2(g)+B2(g)达到平衡状态的标志是
A2(g)+B2(g)达到平衡状态的标志是
A. 单位时间内生成nmolA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的体积分数不随时间变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在③~⑦元素中,原子半径最大的是 ,其离子的原子结构示意图为
(2)元素的最高价氧化物对应的水化物中酸性最强的 ,碱性最强的是 ,呈两性的氢氧化物是 ;
(3)按要求写出下列两种物质的电子式:①的氢化物 ;⑨的最高价氧化物的对应的水化物 ;
(4)在⑦与⑩的单质中,化学性质较活泼的是 ,可用什么化学反应说明该事实(写出反应的化学方程式): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二胺(H2NCH2CH2NH2),无色液体,电离类似于氨:NH3+H2O![]() NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
NH4++OH-,25℃时,kb1=10-4.07,kb2=10-7.15;乙二胺溶液中含氮微粒的物质的量浓度分数随溶液pH的变化如图。下列说法不正确的是( )
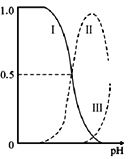
A. 曲线Ⅱ代表的微粒符号为H2NCH2CH2NH3+
B. 曲线Ⅰ与曲线II相交点对应pH=6.85
C. 乙二胺在水溶液中第二步电离的方程式H2NCH2CH2NH3++H2O![]() [H3NCH2CH2NH3]2++OH-
[H3NCH2CH2NH3]2++OH-
D. 0.1 mol/LH2NCH2CH2NH3Cl溶液中各离子浓度大小关系为:c(Cl-)>c(H2NCH2CH2NH3+)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com