
【题目】如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
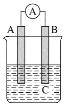
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Ag,B是Fe,C为稀AgNO3溶液
D.A是Fe,B是Ag,C为稀AgNO3溶液
科目:高中化学 来源: 题型:
【题目】(1)据科技日报网报道,南开大学科研团队借助镍和苯基硼酸共催化剂,首次实现烯丙醇高效、绿色合成。烯丙醇及其化合物可制成甘油、医药、农药、香料,合成维生素E和KI及天然抗癌药物紫杉醇中都含有关键的烯丙醇结构。丙烯醇的结构简式为CH2=CH-CH2OH。请回答下列问题:
①基态镍原子的价电子排布式为________。
②1 mol CH2=CH-CH2OH含___molσ键,烯丙醇分子中碳原子的杂化类型为___。
③Ni2+能形成多种配离子,如[Ni(NH3)6]2+、[Ni(CN)2]2- 和[Ni(SCN)2]- 等,与CN-互为等电子体的分子为_____。
(2)乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
①CaC2中C22-中碳与碳之间存在碳碳三键,C22-与O22+互为等电子体,O22+的电子式可表示为_______。
②乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于反应2SO2(g)+ O2(g) 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减少”、“不变”)。
编号 | 改变的条件 | 生成SO3的反应速率 |
① | 升高温度 | ___________ |
② | 降低温度 | ___________ |
③ | 增大氧气的浓度 | ___________ |
④ | 使用催化剂 | ___________ |
⑤ | 压缩体积 | ___________ |
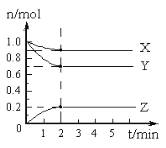
(2)某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示。请回答下列问题。
①计算反应开始至2 min,Y的平均反应速率________。
②分析有关数据,写出X、Y、Z的反应方程式________。
③由图中看出:________分钟后,A、B、C各物质的物质的量不再随时间而变化,说明在这个条件下,该反应已达到了平衡状态。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工程师为了从使用过的腐蚀废液中回收铜,并重新获得![]() 溶液,准备采用如图步骤:
溶液,准备采用如图步骤:
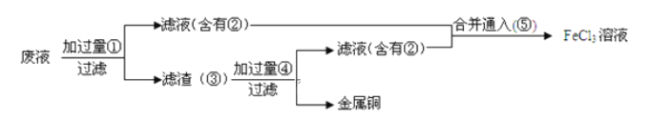
(1)请写出上述实验中加入或生成的有关物质的化学式:①______________,②______________
(2)滤渣加过量④的化学方程式______________
(3)含有②的滤液与⑤反应的化学方程式为______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日晚,天津塘沽滨海新区危险品仓库发生大爆炸,造成了巨大损失。 据悉,该危险品仓库存放的危险品有多种,包括剧毒化学品氰化钠(NaCN)。下列有关氰化钠的说法中错误的是()
A. NaCN 中碳元素的化合价为+4
B. NaCN易溶于水,其水溶液呈碱性
C. 可用强氧化剂如H2O2等将NaCN氧化为无毒物质
D. 为防止中毒,须加强对地表水、排海口等的氰化物排查
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石含碳酸镁和石英,制备高纯硅和硅胶的工艺流程如下:

(1)“硅胶”冶常用作_______________ ,也可以用作__________的载体。 A 的结构式为________。
(2)制备粗硅的方程式为_______。
(3)操作I为_____________,操作Ⅱ为_______________,操作Ⅲ所用仪器有铁架台(带铁圈)、酒精灯、_______________等。
(4)操作Ⅲ,需要在氯化氢气流中加热脱水的原因是_______________。
(5)溶液G用E酸化的方程式为_______________。
(6)电解饱和的K溶液的离子方程式为____________,阳极电极方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年2月16日李克强总理到东北调研经济情况,重点走访了钢铁厂,鼓励钢铁厂提高钢铁质量和产量,铁及其化合物在日常生活中应用广泛。
(1)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4 H+=4Fe3++2H2O,则另一反应的离子方程式为__________;
(2)氧化铁是重要工业颜料,下面是制备氧化铁的一种方法,其流程如下:

①操作Ⅰ的名称是__________;操作Ⅱ为洗涤,洗涤操作的具体方法为__________;
②滤液A中加入稍过量的NH4HCO3溶液生成沉淀同时有一种气体产生,写出其化学方程式: __________;
(3)如果煅烧不充分,产品中将有FeO存在,称取3.0 g氧化铁产品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中,用酸化的0.01000 mol/L KMnO4溶液滴定至终点,重复滴定2-3次,消耗KMnO4溶液体积的平均值为20.00 mL,
①该实验中的KMnO4溶液需要酸化,用于酸化的酸是__________(填字母序号)。
a.稀硝酸 b.稀盐酸 c.稀硫酸 d.浓硝酸
②计算上述产品中Fe2O3的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA (气) ![]() bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
bB(气)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质A的质量分数增加了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下有0.1 mol·L-1四种溶液NaOH、 NH3·H2O、 HCl 、CH3COOH
(1)已知CH3COOH溶液的pH=3,其电离度为 ,由水电离的c(H+)= mol·L-1。
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线 ,a、b两点中,导电能力更强的是 。
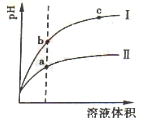
(3)NH3·H2O溶液和HCl溶液混合,已知体积V(NH3·H2O)> V(HCl),当溶液中c(NH3·H2O)= c(NH4+)时,溶液的pH= 。[已知:Kb(NH3·H2O)=1.77×10-5,lg 1.77=0.25]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com