
【题目】A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量可衡量一个国家石油化工发展的水平,并能进行如图所示的多种反应。

(1)写出A的分子式________。A中的官能团的名称为 .
(2)写出下列反应的化学方程式
反应①_______________________________________________;反应类型
反应③_______________________________________________;反应类型
【答案】(8分)(1)C2H6O 羟基
(2)①2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ 置换反应
②CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O 取代反应
CH3COOCH2CH3+H2O 取代反应
【解析】
试题分析:B的产量可衡量一个国家石油化工发展的水平,B是乙烯,A是化学实验室中常见的有机物,它易溶于水并有特殊香味,根据框图中信息,A能与Na、乙酸反应,在红热铜丝发生催化氧化,可推知A是乙醇,C是乙酸乙酯,D是乙醛,E是乙醇钠,乙烯与水发生加成反应生成乙醇;
(1)A为乙醇,化学式为C2H6O,结构简式为CH3CH2OH,所含官能团为羟基;
(2)反应①是乙醇与钠的反应,生成乙醇钠和氢气,反应方程式为:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑,反应类型为置换反应;
反应③为乙醇与乙酸在浓硫酸、加热条件下发生酯化反应生成乙酸乙酯与水,反应方程式为:CH3CH2OH+CH3COOH![]() CH3COOCH2CH3+H2O,反应类型为取代反应。
CH3COOCH2CH3+H2O,反应类型为取代反应。


科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下关于甲烷的说法中错误的是
A. 甲烷分子具有正四面体结构
B. 甲烷化学性质比较稳定,不被任何氧化剂氧化
C. 甲烷分子中具有极性键
D. 甲烷分子中四个C—H键是完全等价的键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下:
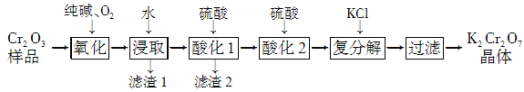
已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1) 上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是________。
(2) 酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH的范围是________。
已知:Al(OH)3(s) ![]() H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是_________________。
(4) 称取重铬酸钾试样2.40 g 配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-===2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验兴趣小组在“探究物质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致。则溶液呈黄色是含________(填化学式或离子符号,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含________所致。
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。供选用的试剂:
A.酚酞试液 B.四氯化碳 C.无水酒精 D.硫氰化钾溶液
请写出丙同学的一种方案,选用的试剂及实验现象填在下表空格中。(试剂填序号)
选用试剂 | 实验现象 | |
方案 | ① | ② |
(4)应用与拓展
①在少量FeBr2溶液中通入足量Cl2,反应的离子方程式为_______________
②在100 mLFeBr2溶液中通入2.24 LCl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学反应方程式
(1)在25℃, 101kPa下, 23g乙醇完全燃烧生成CO2和液态水时放热321.4kJ。则表示乙醇燃烧热的热化学方程式为_____________;
(2)室温下,稀H2SO4和稀KOH溶液发生中和反应,对应的中和热的热离子方程式为_____________;
(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5mol电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为(要求C2H2的系数为1) _____________;
(4) 在25℃, 101kPa下,已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则2mol NH3完全分解生成N2与H2时,对应的热化学方程式为_____________;
(5) 己知:C(石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599.2kJ/mol,
计算25℃时,由C(石墨)和H2(g)反应生成1molC2H2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1molFe溶于过量稀硝酸,电子转移数为2NA
B.标准状况下,2.24LCCl4含有分子的数目为0.1NA
C.46gNO2和N2O4混合气体中含有原子总数为3NA
D.1L0.1mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
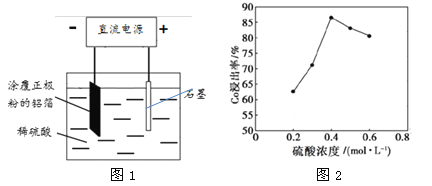
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
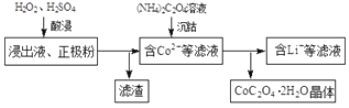
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com