
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
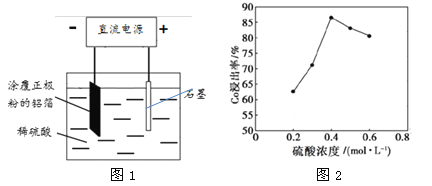
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
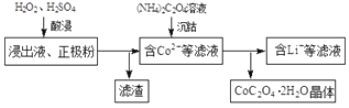
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
【答案】(1)Li2O·Co2O3
(2)①2H++2e-═H2↑;4OH--4e-═O2↑+2H2O②H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(3)①2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O
8LiCoO2+Na2S2O3+11H2SO4═4Li2SO4+8CoSO4+ Na2SO4+11H2O②ac
(4)![]()
【解析】
试题分析:(1)钴酸锂(LiCoO2)改写为氧化物形式为Li2O·Co2O3,故答案为:Li2O·Co2O3;
(2)①H + 也会在阴极放电,2H + + 2e-═H2↑;阴离子在阳极放电,4OH--4e-═O2↑ + 2H2O,故答案为:2H + + 2e-═H2↑;4OH--4e-═O2↑ + 2H2O;
②如图2所示.当c(H2SO4)>0.4molL-1时,参与放电的H + 增多(或有利于H + 放电),所以钴的浸出率下降,故答案为:H + 与LiCoO2在阴极的还原反应相互竞争,当c(H + )增大时,参与放电的H + 增多(或有利于H + 放电),所以钴的浸出率下降;
(2)①“酸浸”过程中正极粉发生氧化还原反应,LiCoO2被还原生成Co2 + ,H2O2被氧化生成O2,方程式为2LiCoO2 + H2O2 + 3H2SO4═Li2SO4 + 2CoSO4 + O2↑ + 4H2O;用Na2S2O3代替H2O2,LiCoO2被还原生成Co2 + ,Na2S2O3被氧化生成Na2SO4,则反应的离子方程式为8LiCoO2 + Na2S2O3 + 11H2SO4═4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O,故答案为:2LiCoO2 + H2O2 + 3H2SO4═Li2SO4 + 2CoSO4 + O2↑ + 4H2O;8LiCoO2 + Na2S2O3 + 11H2SO4═4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O;
②(NH4)2C2O4溶液呈弱酸性,a.由离子浓度大小关系,知c (NH4 + )>c(C2O42-)>c (H + )>c (OH-),故a正确;b.由电荷守恒,可知c (H + ) + c (NH4 + )=c (OH-) + c(HC2O4-) + 2c(C2O42-),故b错误;c.由物料守恒,可知c (NH4 + ) + c (NH3H2O)=2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)],故c正确;故答案为:ac;
(3)根据关系式:
LiCoO2~CoC2O42H2O
98 183
xa%g m
解之得m=![]() ,故答案为:
,故答案为:![]() 。
。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】A是化学实验室中常见的有机物,它易溶于水并有特殊香味,B的产量可衡量一个国家石油化工发展的水平,并能进行如图所示的多种反应。

(1)写出A的分子式________。A中的官能团的名称为 .
(2)写出下列反应的化学方程式
反应①_______________________________________________;反应类型
反应③_______________________________________________;反应类型
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)。
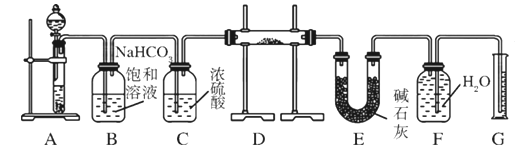
请回答下列问题:
(1) 装置A中的液体试剂选用 。
(2) 装置B的作用是 ,装置E中碱石灰的作用是 。
(3) 装置D中发生反应的化学方程式是: 、 。
(4) 若开始时测得样品的质量为2.0 g,反应结束后测得生成气体的体积为224 mL(标准状况),则试样中Na2O2的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为( )
A.C30H60 B.C30H56 C.C30H52 D.C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产和生活密切相关,下列说法正确的是( )
A.聚乙烯塑料的老化是因为发生了加成反应
B.煤经过气化和液化等物理变化可转化为清洁燃料
C.合成纤维、人造纤维及碳纤维都属于有机高分子材料
D.利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
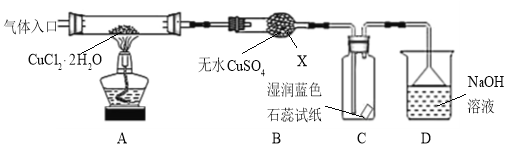
请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能够大量共存的是
A.NH4+、Ca2+、OH-、HCO3- B.NH4+、Br-、Na+、SO42-
C.Ag+、H+、SO32-、ClO- D.H+、Cl-、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.18g冰的晶体中含有氢键的数目为2NA
B.11.2 L丙烷(标准状况)中含有σ键的数目为5NA
C.2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA
D.1molCl2与足量NaOH溶液反应,转移电子的数目为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com