
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.18g冰的晶体中含有氢键的数目为2NA
B.11.2 L丙烷(标准状况)中含有σ键的数目为5NA
C.2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA
D.1molCl2与足量NaOH溶液反应,转移电子的数目为NA
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
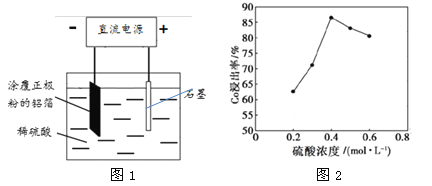
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
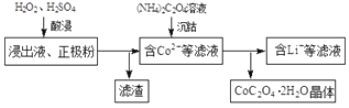
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4xH2O)中x的值。该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的酸性KMnO4标准溶液进行滴定,达到终点时消耗了10.00mL。
请回答下列问题:
(1)配制100.00 mL待测液时,使用的玻璃仪器除烧杯、玻璃棒及胶头滴管外,还需要 。
(2)滴定时,将酸性KMnO4标准液装在如图中的 (填“甲”或“乙”)滴定管中。本实验滴定达到终点的标志是 。
![]()
(3)通过上述数据,求得x= 。
(4)讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
①CO2的大量排放会加剧温室效应
②正常雨水的pH为5.6,主要是因为溶解了SO2
③利用太阳能、风能和氢能替代化石能源可以改善空气的质量
④含磷合成洗涤剂易于被细菌分解,不会导致水体污染
⑤为防止电池中的重金属离子污染土壤和水源,废电池要集中处理
A.①②③④⑤ B.②③⑤ C.①③⑤ D.①②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
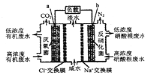
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是4位同学在学习“化学反应速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种高分子化合物(VI)是目前市场上流行的墙面涂料之一,其合成路线如下(反应均在一定条件下进行):
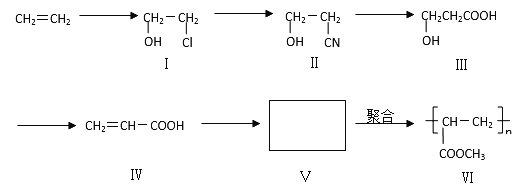
回答下列问题:
(1)目前工业上生产乙烯主要是以 为原料通过 反应来实现。
(2)化合物III生成化合物IV的另外一种产物是 。(提示:该反应的逆反应原子利用率为100%)
(3)写出合成路线中从化合物IV到化合物VI的两步反应的化学方程式: 、 。
(4)下列关于化合物III、IV和V的说法中,正确的是 (填字母)
A.化合物III可以发生氧化反应 |
B.化合物III不可以与NaOH 溶液反应 |
C.化合物IV能与氢气发生加成反应 |
D.化合物III、IV和V均可与金属钠反应生成氢气 |
E.化合物IV和V均可以使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于合金性质的说法中,错误的是 ( )
A.多数合金的硬度一般比其各成分金属的硬度高
B.多数合金的熔点一般比其各成分金属的熔点低
C.合金的物理性质一般与其各成分金属的的物理性质不同
D.合金的化学性质一般与其各成分金属的的化学性质不同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com