
【题目】某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4xH2O)中x的值。该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的酸性KMnO4标准溶液进行滴定,达到终点时消耗了10.00mL。
请回答下列问题:
(1)配制100.00 mL待测液时,使用的玻璃仪器除烧杯、玻璃棒及胶头滴管外,还需要 。
(2)滴定时,将酸性KMnO4标准液装在如图中的 (填“甲”或“乙”)滴定管中。本实验滴定达到终点的标志是 。
![]()
(3)通过上述数据,求得x= 。
(4)讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
【答案】(8分)除标注外,均2分 (1)100mL容量瓶(1分)
(2)甲(1分) ;当滴入最后一滴酸性KMnO4溶液时,溶液由无色变为浅紫色,且半分钟内不褪色。
(3)2 (4)①偏大(1分) ②偏小(1分)
【解析】试题分析:(1)配制100mL该样品溶液时需要选用规格为100mL的容量瓶,溶解样品需要在烧杯中进行,所以还缺少的仪器为烧杯和100mL容量瓶;
(2)因为KMnO4具有强氧化性,会腐蚀橡胶管,故应用酸式滴定管盛装,故答案为甲;可利用KMnO4溶液自身的颜色作为指示剂判断滴定终点时,再滴加KMnO4溶液时,溶液将由无色变为紫色,则当滴入最后一滴KMnO4溶液时,溶液由无色变为紫色,且半分钟内不褪色,即达滴定终点;
(3)由题给化学方程式及数据可知,2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O;
2.520g纯草酸晶体中含H2C2O4的物质的量为:0.100 0 mol/L×20.00 mL×10-3L/mL××![]()
="0.0200" mol,0.02molH2C2O4的质量为0.02mol×90g/mol=1.8g,所以2.520g H2C2O4xH2O中水的物质的量为2.520g-1.8g=0.72g,其物质的量=![]() =0.04mol,则x=2;
=0.04mol,则x=2;
(4)①若滴定终点时俯视滴定管读数,则所得消耗酸性KMnO4溶液的体积偏小,由此所得n(H2C2O4)偏小,则n(H2O)偏大,x偏大;
②若酸性KMnO4溶液因久置而导致浓度变小,则消耗其体积偏大,所得x值偏小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
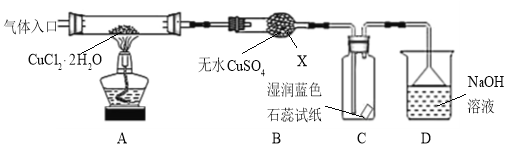
请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能够大量共存的是
A.NH4+、Ca2+、OH-、HCO3- B.NH4+、Br-、Na+、SO42-
C.Ag+、H+、SO32-、ClO- D.H+、Cl-、Fe2+、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F六种元素核电荷数依次增大,属于周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点 (填“高”或“低”),理由是 。
(3)E的最高价氧化物分子的空间构型是 。
(4)F的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 。
(5)A、F形成某种化合物的晶胞结构如图所示,则其化学式为 。(黑色球表示F原子)
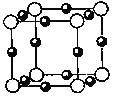
(6)A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料。其晶体中所含的化学键类型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质在水中可能存在电离平衡、盐的水解平衡和沉淀溶解平衡。根据所学知识回答下列问题:
(1)下列方法中,可以使0.10 mol/L CH3COOH溶液中值增大的措施是___________。
a.加水稀释
b.加入少量CH3COONa固体
c.加入少量冰醋酸
d.通入少量HCl气体
(2)t℃时,水的离子积常数Kw=1×10-12。
①该温度下,若100体积pH=a的H2SO4溶液与1体积pH=b的NaOH溶液混合后溶液呈中性,则a+b= 。
②该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 ;该混合溶液中:c(A-)-c(Na+)= mol/L。(填准确数值)
(3)常温下,有浓度均为0.1mol/L的三种溶液:a.NaHCO3;b.NaClO;c.CH3COONa。
①三种溶液pH由大到小的顺序为: (填序号)。
②溶液a的pH大于8,则溶液中c(H2CO3) c(CO32-) (填“>”、“<”或“=”)。
(4)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 。 (填写序号);b中氯离子的浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法错误的是( )
A.18g冰的晶体中含有氢键的数目为2NA
B.11.2 L丙烷(标准状况)中含有σ键的数目为5NA
C.2.0 L 0.5 mol/L NaAlO2溶液中含有氧原子的数目为2NA
D.1molCl2与足量NaOH溶液反应,转移电子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
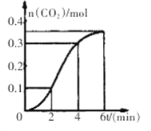
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com