
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
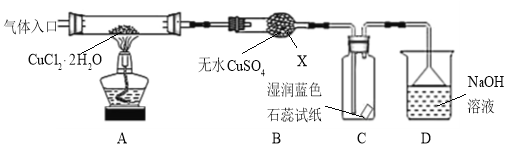
请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
【答案】(1)球形干燥管;(2)c、d、b;(3)先逐渐变为红色,后褪色;(4)Cl2+2OH-=Cl-+ClO-+H2O;(5)①加热温度不够;②没有在HCl的氛围中加热。
【解析】
试题分析:(1)X为球星干燥器;(2)因为需要通入气体,首先检验装置的气密性,根据资料查询,以及CuCl中Cu为+1价,容易被氧化,应排除整个装置中的空气,因此点燃酒精灯前,先通一段时间的HCl,然后点燃酒精灯,加热,反应完毕后,然后熄灭酒精灯,冷却,顺序是a→c→d→b→c;(3)观察到B中物质由白色变为蓝色,说明产生了水,根据资料查询,产生Cl2,Cl2+H2O=HCl+HClO,试纸先变红,HClO的氧化性把有色物质氧化,然后褪色,现象是:先逐渐变为红色,后褪色;(4)因为氯气有毒,防止污染空气,装置D的作用是除去氯气,发生的反应是Cl2+2OH-=Cl-+ClO-+H2O;(5)①根据资料,当温度大于300℃时,才发生反应,有CuCl2存在,说明加热温度不够;②根据资料查询,应是没有在HCl的氛围中加热。


科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学反应方程式
(1)在25℃, 101kPa下, 23g乙醇完全燃烧生成CO2和液态水时放热321.4kJ。则表示乙醇燃烧热的热化学方程式为_____________;
(2)室温下,稀H2SO4和稀KOH溶液发生中和反应,对应的中和热的热离子方程式为_____________;
(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5mol电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为(要求C2H2的系数为1) _____________;
(4) 在25℃, 101kPa下,已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则2mol NH3完全分解生成N2与H2时,对应的热化学方程式为_____________;
(5) 己知:C(石墨)+O2(g)═CO2(g)△H1=-393.5kJ/mol
2H2(g)+O2(g)═2H2O(l)△H2=-571.6kJ/mol
2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H3=-2599.2kJ/mol,
计算25℃时,由C(石墨)和H2(g)反应生成1molC2H2(g)的△H= _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
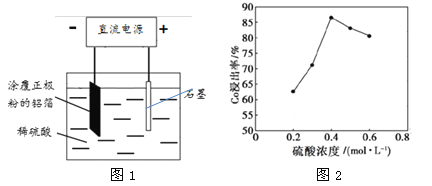
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
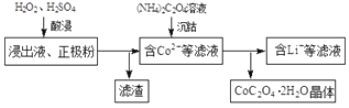
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列七种有机物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是__________
(3)互为同分异构体的是___________。.
(4)易发生银镜反应的是______________
II.在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
(5)D的平均反应速率为 .
(6)A的转化率为
(7) 不能判断该反应已达平衡状态的是
A 单位时间内生成n mol A的同时生成2n mol D的状态
B 生成物浓度不再变化的状态 .
C 混合气体的平均相对分子质量不再改变的状态.
D 混合气体的压强不再改变的状态
E 容器中各组分的体积分数不随时间变化的状态
F 容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:
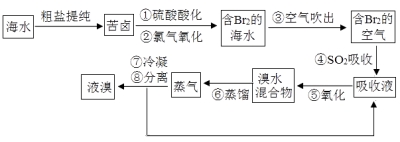
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种离子晶体的晶胞如图其中阳离子A以![]() ,表示阴离子B以
,表示阴离子B以![]() 表示。
表示。
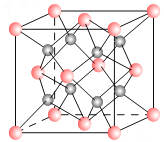
(1)若A和B的核外电子排布与Ar相同,则该离子化合物的化学式是 ___________________;
(2)阳离子周围距离最近的阴离子数为___ __,阴离子周围距离最近的阴离子数___ __。
(3)若与MgO的熔点比较,出现不同的原因是
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组的研究课题是:探究测定草酸晶体(H2C2O4xH2O)中x的值。该组同学通过查阅资料查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值。
①称取1.260 g纯草酸晶体,将其制成100.00 mL水溶液为待测液。
②取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000 mol/L的酸性KMnO4标准溶液进行滴定,达到终点时消耗了10.00mL。
请回答下列问题:
(1)配制100.00 mL待测液时,使用的玻璃仪器除烧杯、玻璃棒及胶头滴管外,还需要 。
(2)滴定时,将酸性KMnO4标准液装在如图中的 (填“甲”或“乙”)滴定管中。本实验滴定达到终点的标志是 。
![]()
(3)通过上述数据,求得x= 。
(4)讨论:
①若滴定终点时俯视滴定管,则由此测得的x值会 (填“偏大”、“偏小”或“不变”,下同)。
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L固定体积的容器中混合,并在一定条件下发生如下反应∶2A(g)+B(g)![]() 2C(g)。若经2s后测得C的浓度为0.6 molL-1,
2C(g)。若经2s后测得C的浓度为0.6 molL-1,
求(1)A表示的反应的平均速率?
(2)2 s时物质B的浓度?
(3)2 s时物质A的转化率?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com