
【题目】鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为( )
A.C30H60 B.C30H56 C.C30H52 D.C30H50
科目:高中化学 来源: 题型:
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下:
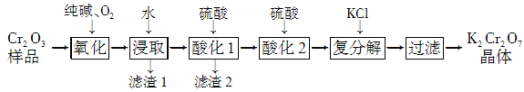
已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1) 上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是________。
(2) 酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH的范围是________。
已知:Al(OH)3(s) ![]() H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是_________________。
(4) 称取重铬酸钾试样2.40 g 配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-===2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)===2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)===CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
(1)甲醇蒸气完全燃烧的热化学方程式为______________________________
(2)反应②中的能量变化如图所示,该反应为 (吸或放)热反应,ΔH2=________。(用E1、E2表示)
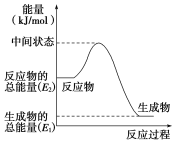
(3)H2(g)的燃烧热为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式 。
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式 。
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式 。
(4)爆炸残留在废水中的CN- 可以用Cr2O72-处理,拟定下列流程进行废水处理,
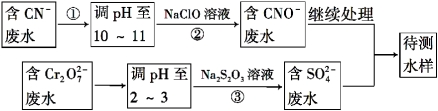
1)上述处理废水流程中主要使用的方法是 ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
2)②中反应后无气体放出,该反应的离子方程式为_______________________;
3)步骤③中,每处理0.4 mol Cr2O72 - 时转移电子2.4 mol,该反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
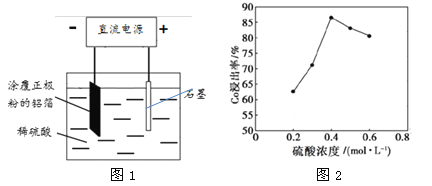
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
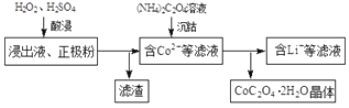
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列七种有机物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是__________
(3)互为同分异构体的是___________。.
(4)易发生银镜反应的是______________
II.在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
(5)D的平均反应速率为 .
(6)A的转化率为
(7) 不能判断该反应已达平衡状态的是
A 单位时间内生成n mol A的同时生成2n mol D的状态
B 生成物浓度不再变化的状态 .
C 混合气体的平均相对分子质量不再改变的状态.
D 混合气体的压强不再改变的状态
E 容器中各组分的体积分数不随时间变化的状态
F 容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种离子晶体的晶胞如图其中阳离子A以![]() ,表示阴离子B以
,表示阴离子B以![]() 表示。
表示。
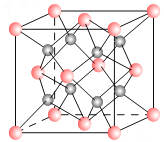
(1)若A和B的核外电子排布与Ar相同,则该离子化合物的化学式是 ___________________;
(2)阳离子周围距离最近的阴离子数为___ __,阴离子周围距离最近的阴离子数___ __。
(3)若与MgO的熔点比较,出现不同的原因是
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如右图所示。图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
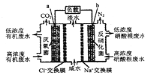
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O═6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com