
����Ŀ����ͼ��ʵ���ҽ��а��������Ʊ�������ʵ������װ�ã����̶ֹ�װ��δ������ 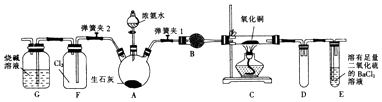
��1������װ��װ��֮��Ӧ���еIJ��������� ��
��2��װ��B��ʢ�ŵ��Լ��� ��
��3����C�й���ȫ����Ϊ��ɫ�رյ��ɼ�1�������ƿ��ƾ��ƣ�����ȴ����C�й�������������Ӧǰ��������Ϊ16g����Ӧ�������������2.4g����ù������ijɷ������û�ѧʽ��ʾ������E���ݳ�Һ����������ֱ����������У���д����C�з�����Ӧ�Ļ�ѧ����ʽ�� ��
��4���رյ��ɼ�1�����ɼ�2���������F�������������̣�ͬʱ����G����ҺѸ�ٵ�������F�У���д���������̵Ļ�ѧ����ʽ�� �� Ѹ�ٷ���������ԭ���� ��
��5��Ϊ��֤��һˮ�ϰ�������ס�����ͬѧ�ֱ��������ʵ�����̽���� �ټ�ͬѧ��pH��ֽ���������0.01molL��1��ˮ��pHΪ10�����϶�һˮ�ϰ���������ʣ������� ��
����ͬѧȡ��10mL 0.1molL��1��ˮ������2�η�̪��Һ����Һ�Էۺ�ɫ���ټ�������NH4Cl���壬�۲쵽 �� ֤��һˮ�ϰ���������ʣ�
�������һ����ס���ͬѧ��ͬ�ļ�ʵ�鷽����֤��һˮ�ϰ���������ʣ� ��
���𰸡�
��1�����װ�õ�������
��2����ʯ�ң���ʯ�һ����NaOH��
��3��Cu��Cu2O��2NH3+4CuO ![]() Cu2O+2Cu+N2��+3H2O
Cu2O+2Cu+N2��+3H2O
��4��3Cl2+8NH3�TN2+6NH4Cl��ʢ�������ļ���ƿ����Cl2��NH3��Ӧ���ɹ���,����Fƿ��ѹǿ��С,������Һ����
��5����NH3?H2O��ǿ��,0.01 mol?L��1��ˮ��pHӦΪ12,��pH=10��12,��NH3?H2Oû����ȫ����,��Ϊ�����Һ��ɫ��dz����NH4Cl[��NH4NO3��NH4��2SO4]��Һ��pH,��pH��7,֤��笠����ӿ�ˮ��,��NH3?H2OΪ�������
���������⣺��1����ʵ����ʵ���ҽ��а��������Ʊ�������ʵ�飬����������룬����װ�õ������ԣ�����Ϊ�����ȹرյ��ɼ�2�ͷ�Һ©�����������ɼ�1����E��װ��ˮ��Ȼ����A���۲쵽E��������ð�����ƿ��ƾ��ƻ��ɿ�˫�֣�E�е�����ˮ���γ�˵��װ�����������ã�
���Դ��ǣ����װ�õ������ԣ���2������C��Ӳ���Թܵİ���Ӧ���װ��B�������Ǹ��ﰱ�������ﰱ���ü�ʯ�ң���ʯ�ҵijɷ�Ϊ��ʯ�һ����NaOH��
���Դ��ǣ���ʯ�ң���ʯ�һ����NaOH������3��16gCuO�к���CuԪ������Ϊ16g�� ![]() =12.8g��������Ԫ������Ϊ16g��12.8g=3.2g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g��2.4g=13.6g������12.8g����ʣ����庬��Cu��OԪ�أ���n��Cu��=
=12.8g��������Ԫ������Ϊ16g��12.8g=3.2g����Ӧ����ع�����������2.4g��ʣ���������Ϊ16g��2.4g=13.6g������12.8g����ʣ����庬��Cu��OԪ�أ���n��Cu��= ![]() =0.2mol������OԪ�ص�����Ϊ13.6g��12.8g=0.8g��n��O��=
=0.2mol������OԪ�ص�����Ϊ13.6g��12.8g=0.8g��n��O��= ![]() =0.05mol��n��Cu����n��O��=0.2mol��0.05mol=4��1��2��1����ʣ�����ΪCu2O��Cu��װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��2NH3+4CuO
=0.05mol��n��Cu����n��O��=0.2mol��0.05mol=4��1��2��1����ʣ�����ΪCu2O��Cu��װ��C�к�ɫ������죬˵����Cu���ɣ���E���ݳ�Һ����������ֱ�����������˵������������Ϊ������ͬʱ����ˮ��C�з�����Ӧ�Ļ�ѧ����ʽΪ��2NH3+4CuO ![]() Cu2O+2Cu+N2��+3H2O��
Cu2O+2Cu+N2��+3H2O��
���Դ��ǣ�Cu��Cu2O��2NH3+4CuO ![]() Cu2O+2Cu+N2��+3H2O����4��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl����Ӧ����ʽΪ��3Cl2+8NH3=N2+6NH4Cl��ʢ�������ļ���ƿ����Cl2��NH3��Ӧ���ɹ��壬����Fƿ��ѹǿ��С��������Һ������
Cu2O+2Cu+N2��+3H2O����4��������ǿ�����ԣ�������������N2���������̣�˵�����ɹ��壬�ʻ�����NH4Cl����Ӧ����ʽΪ��3Cl2+8NH3=N2+6NH4Cl��ʢ�������ļ���ƿ����Cl2��NH3��Ӧ���ɹ��壬����Fƿ��ѹǿ��С��������Һ������
���Դ��ǣ�3Cl2+8NH3=N2+6NH4Cl��ʢ�������ļ���ƿ����Cl2��NH3��Ӧ���ɹ��壬����Fƿ��ѹǿ��С��������Һ��������5���������ˮ��ǿ�0.010molL��1��ˮC��H+��= ![]() =10��12��pH=12��ʵ������Һ��pH=10��12������ˮ�����
=10��12��pH=12��ʵ������Һ��pH=10��12������ˮ�����
���Դ��ǣ���NH3H2O��ǿ�0.01 molL��1��ˮ��pHӦΪ12����pH=10��12����NH3H2Oû����ȫ���룬��Ϊ���
����ˮ�м����Ȼ�狀������ˮ��������ʣ������ư�ˮ�ĵ��룬��Һ������������Ũ�Ƚ��ͣ���Һ�ļ��Լ���������Һ����ɫ��dz����˵����ˮ���ڵ���ƽ�⣻
���Դ��ǣ���Һ��ɫ��dz��
������0.1mol/L���Ȼ����Һ����NH4NO3��NH4��2SO4�������Ȼ����Һ[��NH4NO3��NH4��2SO4]�ε�pH��ֽ�ϣ������pH��7��˵���Ȼ����ǿ�������Σ���һˮ�ϰ���������ʣ�
���Դ��ǣ���NH4Cl[��NH4NO3��NH4��2SO4]��Һ��pH����pH��7��֤��笠����ӿ�ˮ�⣬��NH3H2OΪ������ʣ�
�����㾫�������ð���ʵ�����Ʒ�����Ŀ�����жϼ��ɵõ��𰸣���Ҫ��֪�������Ʒ�����������ȣ�2NH4Cl+Ca(OH)2=CaCl2+2NH3��+2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g����B��g��![]() xC��g����2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1�������жϴ������
xC��g����2D��g����2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.2 mol��L��1�������жϴ������
A. x��1
B. B��ת����Ϊ80%
C. 2 min��A��ƽ����Ӧ����Ϊ0.3 mol��(L��min)��1
D. �����������ܶȲ���������÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ��ָ��������Ϊ0.9%��NaCl��Һ�������йظ���Һ˵����ȷ���ǣ�������
A.100g��Һ�к���0.9 g NaCl
B.100 gˮ�к���0.9 g NaCl
C.100 g��Һ�к���0.9 mol NaCl
D.100 gˮ�к���0.9 mol NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015���������仯���涨��������ʵ���������徻���ŷţ���������ȼ��ʱ��ʵ�ֶ�����̼���ŷŵ��ǣ�������
A.��Ȼ��
B.����
C.ˮú��
D.ú̿
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A.����ĵ�ؿ������ⶪ��
B.����������¯�ĸ߶ȿ��Խ���β����CO�ĺ���
C.���ۼ������������Ǽ��븺�������ܴ�����ѧ��Ӧ����
D.��ú��������ȼ�տ������ú��ȼ��Ч��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������п�������ֳ������ĺ�п�̵����У�����30%~50%������п����������Fe2O3��CuO��SiO2��MnO�����ʣ����ø��̵���Ϊԭ����������п����(ZnC2O4��2H2O)��
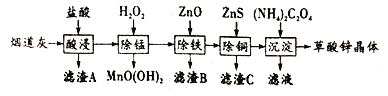
��ش���������:
(1)Ϊ�������������,�����̵��Ҵ����ø�ϸ�⣬���ɲ�ȡ�Ĵ�ʩ��______ (д��һ��)��
(2)֤������������Fe3+�Ѿ�������ȫ��ʵ�鲽�輰������__________.
(3)���������г������ͭ��˳���ܵߵ�����������ʻ��С����ԭ����__________.
(4)��֪: �����£�Ksp[Fe(OH)3]=8.0��10-38.������ZnO���Ʒ�ӦҺpH=5.0ʱ����Һ��c(Fe3+)=_________.
(5)������ʹ���Ը��������Һ��ɫ����д����ط�Ӧ�����ӷ���ʽ:___________.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��XԪ������������Ӧˮ����Ļ�ѧʽΪH2XO4����Ԫ�ص���̬�⻯����Ե���
A.HXB.H2XC.XH3D.XH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��֧����һ���һ�����Է���������С�������ķ���ʽΪ________��
��2�������к���25�����ۼ���һ�ȴ���ֻ��һ�ֵ������ṹ��ʽ��________
��3��ij������״�л�������к���n����CH3��b����CH2����m��![]() ��a��
��a�� ![]() ,����Ϊ��Cl����Cl����Ŀ��________
,����Ϊ��Cl����Cl����Ŀ��________
��4��ij��A 0.2 mol�������г��ȼ�պ����ɻ�����CO2��H2O��1.2 mol���Իش�
����A�ķ���ʽ��________��
������A��ʹ��ˮ��ɫ���ڴ�����������H2�����ӳɷ�Ӧ������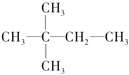 ����A����������������Ϊ________��
����A����������������Ϊ________��
������A��ʹ��ˮ��ɫ���ҷ���������̼ԭ�ӹ�ƽ�棬��A�Ľṹ��ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ��ѧ�ķ�չ˵���У�����ȷ����
A.1777�꣬������ѧ���������������ѧ˵
B.1811�꣬�������ѧ�Ұ���٤�������ԭ��ѧ˵
C.1965�꣬�ҹ���ѧ�Һϳ���ţ�ȵ��أ��״�ʵ���˵����ʵ��˹��ϳ�
D.2015�꣬�ҹ���ѧ�����������������ض����ŵ��������ѧ��ҽѧ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com