
【题目】已知:2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
Fe2(SO4)3+3SO2↑+6H2O。某学习小组对铁丝(含杂质碳)与浓硫酸反应后的产物进行探究。
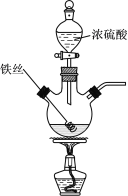
Ⅰ.溶液探究
(1)将反应后的溶液稀释,取稀释液,滴加NaOH溶液,观察到___现象时,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,滴加___(选填编号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.浓氨水 d.KMnO4酸性溶液
(2)为判断反应停止后硫酸是否有剩余,制定的实验方案为:测定稀释液的pH。请对此实验设计进行评价。____。
Ⅱ.气体探究
(3)将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。是否___(填写“是”或“否”)能据此判断除SO2外,反应后气体中还含有CO2?请说明理由___。
最后逸出的气体具有可燃性,推测该气体为H2,理由是___(用离子方程式表示)。
(4)收集混合气体336mL(已折算成标准状况),通入足量的氯水中,发生反应:SO2+Cl2+2H2O=H2SO4+2HCl。滴加足量BaCl2溶液,生成的沉淀经过滤、洗涤、干燥、称量,测得质量为2.330g。则混合气体中SO2的体积分数为___。(精确至小数点后第二位)
(5)将上述混合气体直接通入BaCl2溶液,未见明显现象,放置一段时间后发现有少许浑浊,分析其中的原因___。
【答案】红褐色沉淀 d 由于Fe3+水解显酸性,所以不能仅通过溶液显酸性就判断反应后硫酸是否有剩余(或:如果测得溶液的酸性较强,可以判断硫酸有剩余) 否 由于有SO2存在,SO2也能使澄清石灰水变浑浊,所以无法判断是否含有CO2 Fe+2H+=Fe2++H2↑ 0.67 开始未见明显现象是因为SO2不能与BaCl2反应,一段时间后空气中的O2将H2SO3氧化成为H2SO4,从而与BaCl2反应生成BaSO4沉淀
【解析】
(1)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀;在Fe3+存在时检验Fe2+,结合亚铁离子的性质分析判断选择的试剂;
Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀;在Fe3+存在时检验Fe2+,结合亚铁离子的性质分析判断选择的试剂;
(2)铁离子水解后的溶液也显酸性,但酸性较弱,据此分析评价;
(3)根据SO2也能使澄清石灰水变浑浊分析判断;最后逸出的气体具有可燃性,该气体只能为H2,因为随着反应的进行,硫酸的浓度逐渐减小;
(4)首先计算标准状况下,336mL混合气体的物质的量,再根据生成的硫酸钡的质量计算二氧化硫的物质的量,最后计算混合气体中SO2的体积分数;
(5)SO2与BaCl2不反应,结合二氧化硫检验较强的还原性分析解答。
(1)2Fe+6H2SO4(浓) ![]() Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,因为溶液中含有Fe3+,可以滴加KMnO4酸性溶液,若溶液的紫红色褪色,即可以证明溶液中含有Fe2+,故答案为:红褐色沉淀;d;
Fe2(SO4)3+3SO2↑+6H2O,将反应后的溶液稀释,取稀释液,滴加NaOH溶液,铁离子与氢氧化钠反应生成红褐色的氢氧化铁沉淀,证明有Fe3+存在。为进一步判断溶液中是否存在Fe2+,可另取稀释液少许,因为溶液中含有Fe3+,可以滴加KMnO4酸性溶液,若溶液的紫红色褪色,即可以证明溶液中含有Fe2+,故答案为:红褐色沉淀;d;
(2)测定稀释液的pH,若溶液显酸性不能说明反应后硫酸是否有剩余,因为铁离子水解后的溶液也显酸性,若溶液的酸性较强,可以判断硫酸有剩余,因为铁离子水解后的溶液的酸性较弱,故答案为:由于Fe3+水解显酸性,所以不能仅通过溶液显酸性判断反应后硫酸是否有剩余(或如果测得溶液的酸性较强,可以判断硫酸有剩余);
(3)将产生的气体依次通过品红溶液和澄清石灰水,观察到:品红溶液褪色、澄清石灰水变浑浊。不能据此判断除SO2外,反应后气体中还含有CO2,因为混合气体中存在SO2气体,SO2也能使澄清石灰水变浑浊;最后逸出的气体具有可燃性,说明该气体为H2,因为随着反应的进行,硫酸的浓度逐渐减小,稀硫酸能够与铁反应生成氢气,Fe+2H+=Fe2++H2↑,故答案为:否;由于有SO2存在,SO2也能使澄清石灰水变浑浊,所以无法判断是否含有CO2;Fe+2H+→Fe2++H2↑;
(4)标准状况下,336mL混合气体的物质的量为![]() =0.015mol,生成的硫酸钡的物质的量=
=0.015mol,生成的硫酸钡的物质的量=![]() =0.01mol,说明二氧化硫的物质的量为0.01mol,因此混合气体中SO2的体积分数为
=0.01mol,说明二氧化硫的物质的量为0.01mol,因此混合气体中SO2的体积分数为![]() ×100%=0.67,故答案为:0.67;
×100%=0.67,故答案为:0.67;
(5)将上述混合气体直接通入BaCl2溶液,SO2与BaCl2不反应,因此未见明显现象,放置一段时间后,溶液中的亚硫酸被空气中的氧气氧化生成硫酸,硫酸与氯化钡反应生成硫酸钡沉淀,故答案为:开始未见明显现象是因为SO2不能与BaCl2反应,一段时间后空气中的O2将H2SO3氧化成为H2SO4,从而与BaCl2反应生成BaSO4沉淀。


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】K、Ka、KW分别表示化学平衡常数、电离常数和水的离子积常数,下列判断正确的是( )
A.在500 ℃、20 MPa条件下,在5 L密闭容器中进行合成氨的反应,使用催化剂后K增大
B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN的大
C.25 ℃时,pH均为4的盐酸和NH4I溶液中KW不相等
D.2SO2+O2![]() 2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
2SO3达平衡后,改变某一条件时K不变,SO2的转化率可能增大、减小或不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。

①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时_________________________。
②t2时平衡向___________________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应xH2S(g)![]() xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
xH2(g)+Sx(g)(x>1)达到平衡后,下列说法错误的是( )
A.若恒容充入H2,则新平衡后H2S分解率下降
B.若增大压强,气体颜色变深,则Sx为有色气体
C.若恒容升温后,气体密度不变,说明达到了新平衡
D.若改变某一条件后,压强不能作为判断新平衡的标志,则Sx状态发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某栏目报道一超市在售的鸡蛋为“橡皮弹”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,该是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多的棉酚所致。已知棉酚的结构简式如图所示,下列说法正确的是
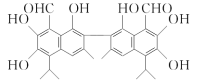
A.棉酚的一氯代物有3种B.棉酚能与溴水发生加成反应
C.1mol棉酚最多与10mol H2反应D.1mol棉酚最多与6 molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界存在丰富的碳、氮、氧、铝、钾、铁、碘等元素,按要求回答下列问题:
(1)常温,羰基铁[Fe(CO)x)]是红棕色液体,不溶于水,溶于乙醇、乙醚等,据此判断羰基铁晶体属于________________(填晶体类型),羰基铁的配体是________。已知:羰基铁的中心原子价电子数与配体提供电子数之和为18,则x=_________;98g羰基铁中含有的![]() 键数为______________个。
键数为______________个。
(2)亚铁离子具有强还原性,从电子排布的角度解释,其原因是__________
(3)BN晶体、AlN晶体结构相似,如图1,两者熔沸点较高的物质是______,原因是_________

(4)KIO3晶体是一种性能良好的光学材料,其晶胞为立方体,晶胞中K、I、O分别处于顶点、体心、面心位置,如图2所示,如果KIO3密度为a g![]() cm-3,则K与O间的最短距离为___cm。
cm-3,则K与O间的最短距离为___cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将钠、铝混合物共1.0g投入适量水中充分反应,并测生成H2的量,若混合物中钠与铝的物质的量之比为x,如图为生成H2的物质的量随x的变化关系示意图(随着x的不断增大,产生H2的物质的量越来越接近b1).以下判断不正确的是 ( )
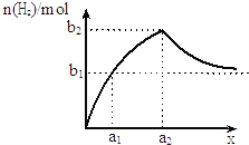
A.a1=![]() B.a2=1C.b1=
B.a2=1C.b1= ![]() D.b2=
D.b2=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用硫酸厂产生的烧渣(主要含Fe2O3、FeO,还有一定量的SiO2)来制备FeCO3,其流程如图:
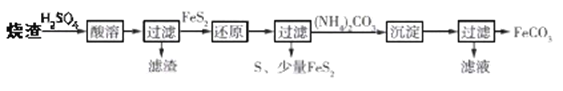
已知:①FeS2不溶于稀硫酸;②“还原”时,Fe3+通过两个反应被还原,其中一个反应为 FeS2+14Fe3++8H2O=15Fe2++2![]() +16H+ 。
+16H+ 。
下列说法不正确的是( )
A.“还原”时另一个反应的离子方程式为2Fe3++FeS2=2S+3Fe2+
B.“还原”后可以用KSCN检验Fe3+是否反应完全
C.流程中多次进行过滤,过滤所用的玻璃仪器为烧杯、漏斗、胶头滴管和玻璃棒
D.所得FeCO3需充分洗涤,可以用稀盐酸和BaCl2溶液检验FeCO3是否已洗涤干净
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件可发生如下两个化学反应:
①Fe+H2SO4(稀)=FeSO4+H2↑ ②2Fe+6H2SO4(浓) = Fe2(SO4)3+3SO2↑+6H2O
试回答下列问题:
(1)反应①中_____元素被还原,氧化产物为__________;用单线桥表示该反应电子转移情况_________________;
(2)反应②中还原产物为__________,当反应②中生成32克SO2气体时,被还原的H2SO4有_______mol,用双线桥表示该反应电子转移情况____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com