
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 干馏
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】A是中学化学中常见的单质,B、C为化合物,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断不正确的是
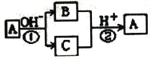
A. A、B、C一定含有一种相同的元素 B. A可能是金属,也可能是非金属
C. B、C的水溶液可能呈碱性或中性 D. 反应①和②一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
A.除去CO2气体中混有的CO:通入澄清石灰水洗气
B.除去氯气中混有的HCl:通过氢氧化钠溶液洗气
C.除去NaBr溶液中混有的NaCl: 加入过量Cl2,加热蒸干
D.除去NaCl固体中混有少量的I2:加热升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学对由NaHCO3和KHCO3组成的某均匀混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
标准状况下,V(CO2) | 2.24L | 3.36L | 3.36L |
(1)盐酸的物质的量浓度为_________。
(2)混合物中,n(NaHCO3):n(KHCO3)=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是
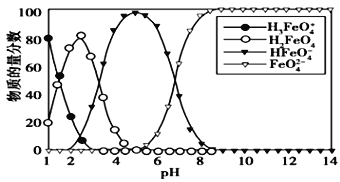
A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或现象与胶体性质无关的是
A. 三氯化铁溶液中加入NaOH溶液出现红褐色沉淀
B. 煮沸的FeCl3溶液冷却后,用一束光照射,有一条光亮的通路
C. 胶态金属氧化物分散于玻璃中制成有色玻璃
D. 江河入海口易形成三角洲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。
2NH3(g)+ Q(Q>0), NH3物质的量随时间的变化如右图所示。

(1)0~2 min 内的平均反应速率 v(H2)=___________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
2NH3(g)+ Q(Q>0)的平衡常数表达式K=______。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1________K2(填写“>”“=”或“<”)。
(3)下列能说明合成氨反应已达到平衡状态的是______(填字母)(反应是在固定体积的密闭容器中进行的)
a.3v(N2) = v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH 如下表。
实验编号 | 氨水浓度/mol·L-1 | 盐酸浓度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
请回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各离子浓度大小关系为_____________。
(5)请你再设计一个能证明一水合氨是弱电解质的方案。_____________。
【答案】 0.375 mol/(L·min) [NH3]2/[N2][H2]3 > bd < > [Cl-]= [NH4+]> [H+]= [OH-] 测量 0.1mol/L 氨水的 pH,pH小于13 等
【解析】试题分析:I.(1)根据![]() 计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)
计算反应速率;(2)根据平衡常数的定义书写平衡常数表达式;反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动;(3)根据平衡状态的特征分析;II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸;根据电荷守恒分析离子浓度关系;(5)根据弱电解质部分电离或弱碱阳离子能水解设计方案;
解析:I.(1)2min内生成1mol氨气,则消耗氢气1.5mol, ![]() =
=![]() 0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=
0.375 mol/(L·min);(2)根据平衡常数的定义,平衡常数K=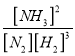 ;反应 N2(g)+3H2(g)
;反应 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)
2NH3(g)+ Q(Q>0)正反应放热,升高温度平衡逆向移动,平衡常数减小,所以K1>K2;(3)a.任意时刻速率比都等于系数比,所以3v(N2) = v(H2)不一定平衡,故a错误; b.N2(g)+3H2(g)![]() 2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据
2NH3(g),气体物质的量是变量,所以压强是变量,容器内压强保持不变一定达到平衡状态,故b正确;c.根据![]() ,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,
,气体密度是恒量, 混合气体的密度保持不变不一定平衡,故c错误;d.25℃时K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,  ,Q=K,反应一定达到平衡状态,故d正确。
,Q=K,反应一定达到平衡状态,故d正确。
II. (4)①等浓度、等体积的盐酸和氨水混合,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解![]() ,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
,所以溶液呈酸性pH<7;②若等浓度、等体积的盐酸和氨水混合,溶液呈酸性,要使pH=7,则氨水的物质的量大于盐酸,所以c>0.2;根据电荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以离子浓度关系为[Cl-]= [NH4+]> [H+]= [OH-];(5)测量 0.1mol/L 氨水的 pH,pH小于13 ,能证明一水合氨部分电离是弱电解质;
点睛:同浓度、同体积的一元强酸与一元弱碱混合,溶液呈酸性;同浓度、同体积的一元弱酸与一元强碱混合,溶液呈碱性;同浓度、同体积的一元强酸与一元强碱混合,溶液呈中性。
【题型】综合题
【结束】
23
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:

已知:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虚线框处宜选择的装置是________(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是______________________。
(2)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_______溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由_________________。
实验二:
绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2 g,B为干燥管。按下图连接好装置进行实验。

实验步骤如下:(1)________,(2)点燃酒精灯,加热,(3)______,(4)______,(5)______,
(6)称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g。
(3)请将下列实验步骤的编号填写在对应步骤的横线上
a.关闭 K1 和 K2 b.熄灭酒精灯 c.打开 K1 和 K2 缓缓通入 N2 d.冷却至室温
(4)必须要进行恒重操作的原因是_________________。
(5)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解, 根据实验记录,
计算绿矾化学式中结晶水数目 x=__________________(用含 m1、 m2、 m3的列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙医药上用作中枢神经抑制药,具有抑制、镇静作用,用以治疗神经衰弱、癫痫等症,在水中极易溶解,溶于乙醇和丙酮。制备溴化钙晶体(CaBr2·2H2O)的主要流程如下:

(1)检验FeBr2中是否含有Fe3+,应选择________(填字母编号)。
a.NaOH溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液 d.KMnO4溶液
(2)操作②要求控制温度在40℃,不能过高和过低的原因是_____________________。
(3)要实现Fe粉至FeBr2的转化,在原料配比时应注意_____________,试剂X的化学式为_______________。
(4)加入熟石灰至出渣的过程中,固体的颜色发生变化,原因是___________(用化学反应方程式表示。)
(5)操作④的步骤为蒸发浓缩、__________、过滤、洗涤、干燥。蒸发浓缩时除酒精灯、三脚架外还需用到仪器有____________。
(6)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色无味气体,写出反应的化学方程式_____________。
(7)将上述流程中的出渣,经净化分离得到铁粉。已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
将铁粉与碳、氧气共同作用可以得到FeCO3,则该反应的热化学反应方程式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com