
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是
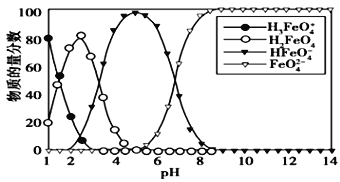
A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
【答案】C
【解析】A.图示可以看出其中含有HFeO4-,向pH=5的高铁酸盐溶液中加入KOH溶液生成FeO42-,则HFeO4-和KOH溶液之碱反应,即HFeO4-+OH-=FeO42-+H2O,故A正确;B.pH≥9时,FeO42-含量接近100%,则为获得尽可能纯净的高铁酸盐,pH应控制pH≥9,故B正确;C.根据H3FeO4+ 的电离常数分析,其电离平衡常数K2=c(HFeO4 -)c(H +)/c(H2FeO4)=4.8×10-4,则当溶液中pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=4.8×10 -4/10 -4=4.8,故C错误;D.由图象纵坐标可知pH=2时,溶液中主要含铁型体浓度的大小关系为c(H2FeO4)>c(H3FeO4+)>C(HFeO4-),故D正确。故选:C。


科目:高中化学 来源: 题型:
【题目】MgO和Al2O3都是常用的耐火材料。某斫究小组取100kg报废汽车镁铝合金材料来制备MgO和Al2O3,其工艺流茬如下:
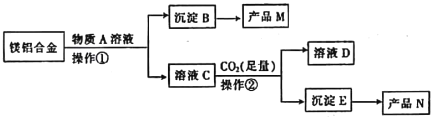
请回答下列问题:
(1)物质A是_______,产品M是_______。
(2)操作①所需的玻璃仪器是______________。
(3)足量CO2与溶液C发生反应生成沉淀E的离子方程式为______________。
(4)由沉淀E转化为产品N的化学方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A. 萃取 B. 渗析 C. 蒸馏 D. 干馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 2.4 g金属镁与足量盐酸反应,转移电子的数目为0.1 NA
B. 1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为NA
C. 在25℃、1.01×105Pa的条件下,2.24 L H2中含有的分子数小于0.1 NA
D. 22 g CO2与标准状况下11.2 L H2O含有相同的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图转化关系以及实验现象填写下列空白。
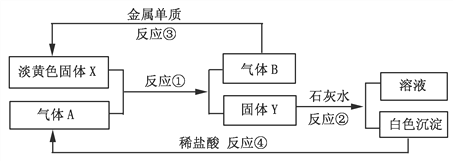
(1)气体A是___________,图中溶液的溶质是____________(填写化学式);
(2)反应①的化学方程式是______________________;
(3)反应④的离子方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO32﹣+H2OHCO3﹣+OH﹣ . 下列说法正确的是( )
A.稀释溶液,水解平衡常数增大
B.通入CO2 , 平衡朝正反应方向移动
C.升高温度, ![]() 减小
减小
D.加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物浆液含少量Na2CrO4,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。已知:阴极池中得到NaOH和H2,阳极池中得到含有Cr2O72-和CrO42-的混合溶液。

(1)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是____________________。
(2)离子交换膜I属于________________(填“阳膜”或“阴膜”),阳极的电极反应方程式为___。生成Cr2O72-的原因____________(离子反应方程式和必要的文字解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com