
【题目】氧化还原反应的实质是
A.得氧和失氧B.化合价的升降C.有无新物质生成D.电子的转移
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】LiAlH4(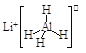 )、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
)、LiH既是金属储氢材料又是有机合成中的常用试剂,遇水均能剧烈分解释放出H2,LiAlH4在125℃分解为LiH、H2和Al。下列说法不正确的是
A. LiH与D2O反应,所得氢气的摩尔质量为4 g/mol
B. 1 mol LiAlH4在125℃完全分解,转移3 mol电子
C. LiAlH4溶于适量水得到无色溶液,则化学方程式可表示为:LiAlH4+ 2H2O![]() LiAlO2+ 4H2↑
LiAlO2+ 4H2↑
D. LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷,用16.0g的溴和足量的乙醇制备1,2﹣二溴乙烷,实验结束后得到9.4g产品.实验装置如图所示:
有关数据列表:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/0C | 78.5 | 132 | 34.6 |
熔点/0C | ﹣130 | 9 | ﹣116 |
溶解性 | 易溶水 | 难溶水 | 微溶于水 |
请回答下列问题: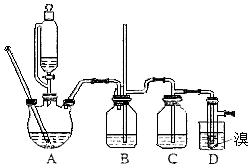
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其主要目的是(填正确选项前的字母;
a、引发反应 b、加快反应速度 c、防止乙醇挥发 d、减少副产物乙醚生成
(2)在装置C中应加入 , 其目的是;(填正确选项前的字母)
a、水 b、浓硫酸 c、氢氧化钠溶液 d、酸性KMnO4溶液
(3)判断该制备反应已经结束的最简单的方法是 .
(4)将1,2﹣二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在层(填“上”或“下”);
(5)在装置B中较长玻璃导管的作用是;
(6)反应过程中应用冷水冷却装置D,其主要目的是 , 但又不能过度冷却(如用冰水),其原因是;
(7)本实验中,1,2﹣二溴乙烷的产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用的分离操作有:①萃取分液法②结晶法③分液法④蒸馏法⑤过滤法。选择以上方法分离混合物,选择正确的是( )
A. | 饱和食盐水与沙子的混合物 | ①萃取分液法 |
B. | 水和汽油的混合物 | ④蒸馏法 |
C. | 从碘的水溶液里提取碘 | ③分液法 |
D. | 从硝酸钾和氯化钠的混合液中获得硝酸钾 | ②结晶法 |
A.A B.B C.C D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是中学化学中常见的单质,B、C为化合物,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断不正确的是
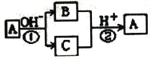
A. A、B、C一定含有一种相同的元素 B. A可能是金属,也可能是非金属
C. B、C的水溶液可能呈碱性或中性 D. 反应①和②一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中曲线a表示放热反应X(g)+Y(g)Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( ) 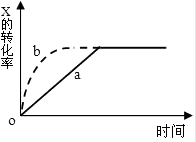
A.升高温度
B.加大X的投入量
C.使用催化剂
D.缩小体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,某反应达平衡,平衡常数 ![]() .恒容时,温度升高,H2浓度减小.下列说法正确的是( )
.恒容时,温度升高,H2浓度减小.下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,25 ℃时,它们的物质的量分数随pH 的变化如图所示,下列叙述错误的是
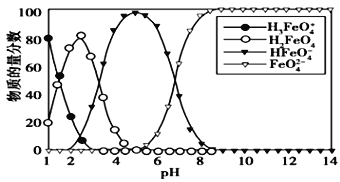
A. 向pH=5 的高铁酸盐溶液中加入KOH溶液,离子方程式为HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2,K2=4.8×10-4,K3=5.0×10-8,当pH= 4时,溶液中c(HFeO4-)/ c(H2FeO4)= 1.2
D. pH=2 时,溶液中主要含铁型体浓度的大小关系为 c(H2FeO4)> c(H3FeO4+)> c(HFeO4-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com