
【题目】在一密闭容器中进行反应:2SO2+O2![]() 2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
2SO3(g),已知反应过程中某一时刻SO2、O2和SO3浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是
A.SO2为0.4 mol·L-1、O2为0.2 mol·L-1B.SO2为0.3 mol·L-1
C.SO3为0.4 mol·L-1D.SO2、SO3均为0.1 mol·L-1
【答案】B
【解析】
化学平衡研究的对象为可逆反应,化学平衡的建立,可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应;因此可以利用极限法假设完全反应,计算出各物质的浓度变化量,实际变化量必须小于极限值,据此判断解答.
A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,SO2和O2的浓度浓度变化分别为:0.2mol/L、0.1mol/L,需要消耗三氧化硫的浓度为:0.2mol/L,由于该反应为可逆反应,实际变化浓度应小于三氧化硫的原有浓度0.2mol/L,所以达到平衡时SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;
B.SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化为0.2mol/L,该题中实际变化为0.1mol/L,小于0.2mol/L,故B正确;
C.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反SO3的浓度的浓度变化为0.2mol/L,实际变化小于该值,故C错误;
D.反应物、生产物的浓度不可能同时减小,一个浓度减小,另一个浓度一定增大,故D错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】下面是几种常见的化学电源示意图,有关说法不正确的是( )

A.上述电池分别属于一次电池、二次电池和燃料电池
B.干电池在长时间使用后,锌筒被破坏
C.铅蓄电池工作过程中,每通过2 mol电子,负极质量减轻207 g
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是
A. 含有大量NO3-的溶液:H+、NH4+、I-、S2O32-
B. 中性溶液:Fe3+、Al3+、NO3-、SO42-
C. ![]() =1×10-12的溶液:K+、AlO2-、CO32-、Na+
=1×10-12的溶液:K+、AlO2-、CO32-、Na+
D. 由水电离出的c(H+)=10-12mol/L的溶液:Na+、K+、CO32-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含氮化合物在工农业生产中都有重要应用。
(1)己知:
4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
2N2(g)+6H2O(g) △H=-541.8 kJ/mol,化学平衡常数为K1
N2H4(g)+O2(g)![]() N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
N2(g)+2H2O(g) △H=-534 kJ/mol,化学平衡常数为K2
则用NH3和O2制取N2H4的热化学方程式为__________________________________,该反应的化学平衡常数K=_______(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(
N2(g)+2CO2(g) 在一定温度下,在1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。下图为容器内的压强(P)与起始压强(P0)的比值(![]() )随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______,平衡时NO的转化率为________。
)随时间(t)的变化曲线,0~5 min内,该反应的平均反应速率v(N2)=______,平衡时NO的转化率为________。

Ⅱ.2NH3(g)+CO2(g)![]() NH2COONH4(s)
NH2COONH4(s)
(3)该反应能正向自发进行的原因是_____________________。
(4)恒温恒容下通入2 mol NH3和1 mol CO2进行上述反应,下列事实能证明反应已达平衡的是__________。
A.体系压强保持不变 B.气体平均密度保持不变
C.气体的平均摩尔质量保持不变 D.氨气的体积分数不变
Ⅲ.在恒温恒压条件下,向某密闭容器中通入2 mol SO2和1 mol O2,发生2SO2(g)+O2(g)![]() 2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________。
2SO3(g)反应,达到平衡后,t1时刻再向该容器中通入2 mol SO2和1 mol O2,请在下图中画出从t1时刻到再次达到化学平衡后的正逆反应速率随时间变化图像________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2+3H2![]() 2NH3为放热反应,对该反应的下列说法中正确的是
2NH3为放热反应,对该反应的下列说法中正确的是
A.N2的能量一定高于NH3
B.H2的能量一定高于NH3
C.N2和H2的总能量一定高于NH3的总能量
D.因该反应为放热反应,故不必加热就可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种金属晶体:Na、Zn、Po、Au,如图所示为金属原子的四种基本堆积模型。请回答以下问题:

(1)堆积方式的空间利用率最低的基本堆积模型是___(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
(2)金属原子在二维平面里放置得到密置层和非密置层,其中非密置层的配位数是_____,由非密置层互相错位堆积而成的基本堆积模型是_____(填编号),符合该堆积模型的金属晶体是_____(填化学符号)。
(3)按ABCABCABC……方式堆积的基本堆积模型是____(填编号),符合该堆积模型的金属晶体是______(填化学符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理、回收CO是环境科学家研究的热点课题。
(1)CO用于处理犬气污染物N2O所发生的反应为:N2O(g)+CO(g)![]() CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
CO2(g)+N2(g) ΔH,几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量kJ·mol-1 | 475.5 | 283 | 0 | 393.5 |
①ΔH=______kJ·mol-1;改变下列“量”,一定会引起ΔH发生变化的是____填代号)
A.反应物浓度 B.催化剂 C.化学计量数
②有人提出上述反应可以用Fe作催化剂。其总反应分两步进行:第一步:Fe+N2O=FeO+N2,第二步:______(写化学方程式)。第二步反应不影响总反应达到平衡所用时间,由此推知,第二步反应活化能____第一步反应活化能(填“大于”、“小于”或等于”)。
(2)在实验室,釆用I2O5测定空气中CO的含量。在密闭容器中充入足量的I2O5粉末和一定量的CO,发生反应:I2O5(g)+5CO(g)![]() 5CO2(g)+I2(s)。测得CO的转化率如图1所示。
5CO2(g)+I2(s)。测得CO的转化率如图1所示。

①相对曲线a,曲线b仅改变一个条件,改变的条件可能是______。
②在此温度下,该可逆反应的平衡常数K=_____(用含x的代数式表示)。
(3)工业上,用CO和H2合成CH3OH。在1L恒容密闭容器中充入1molCO(g)和nmolH2,在250℃发生反应:CO(g)+2H2(g)![]() CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___。
CH3OH(g),测得混合气体中CH3OH的体积分数与H2的物质的量的关系如图2所示。在a、b、c、d点中,CO的平衡转化率最大的点是___。

(4)CO-空气碱性燃料电池(用KOH作电解质),当恰好完全生成KHCO3时停止放电。写出此时负极的电极反应式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表短周期的一部分,下列关于X、Y、Z、M的说法中正确的是( )
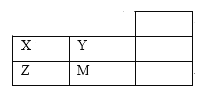
A. ZX2形成的晶体为分子晶体
B. Y的最高正价等于其最外层电子数
C. 原子半径:M>Z>Y
D. 非金属性:Z>X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com