
����Ŀ��������������Ӧ�����е������仯����ͼ��ʾ�������й�˵������ȷ����
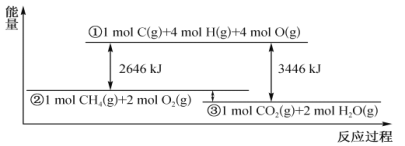
A. ��Ӧ CO2(g)+2H2O(l)==CH4(g)+2O2(g) ��H<0
B. ����1mol CO2(g)��2 molH2O(l)����������ͼ�У�����λ���ڢ١���֮��
C. ��CһH���ļ���Ϊ415kJ mol-1����O= O�ļ���Ϊ493 kJ mol-1
D. ���÷�Ӧ������ת���Ļ�ѧ��Ϊ200kJ������0.25 molC=O����
���𰸡�C
��������
A.�����ȼ�շ�Ӧ�Ƿ��ȷ�Ӧ�����CO2(g)+2H2O(l)==CH4(g)+2O2(g) ��H��0����A����
B.Һ̬ˮ������������������̬ˮ�����������������ڢ۵��·�����B����
C.��ͼ���֪�ƻ�4mol C-H����2molO-O������Ҫ����2646kJ�����������ƻ�4mol C-H����Ҫ����4��415kJ=1660kJ�����������ƻ�1mol�����е� O=O�еĻ�ѧ����Ҫ���յ�����Ϊ![]() (2646-1660)kJ=493kJ����C��ȷ��
(2646-1660)kJ=493kJ����C��ȷ��
D.������֮��=������������-��Ӧ������������1mol CH4 (g)��2mol O2(g)��������֮��Ϊ(3446-2646)=800kJ��1molCH4 ���뷴Ӧ�ų�800kJ���������������仯Ϊ200kJʱ������뷴Ӧ��CH4 0.25mol����Ԫ���غ㣬������0.25molCO2��CO2�ṹ��ʽΪO=C=O������0.5molO=C�����ɣ���D����
��ѡC��


 �ִʾ��ƪϵ�д�
�ִʾ��ƪϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Lawrece Liermore����ʵ���ң�LINL���ɹ����ڸ�ѹ�½�![]() ת��Ϊ��������
ת��Ϊ��������![]() �ṹ��ԭ�Ӿ��壬���й���
�ṹ��ԭ�Ӿ��壬���й���![]() ��ԭ�Ӿ���˵������ȷ���ǣ�
��ԭ�Ӿ���˵������ȷ���ǣ�
A. ![]() ��ԭ�Ӿ���ͷ��Ӿ��廥Ϊͬ���칹��
��ԭ�Ӿ���ͷ��Ӿ��廥Ϊͬ���칹��
B. ��һ�������£�![]() ԭ�Ӿ���ת��Ϊ
ԭ�Ӿ���ת��Ϊ![]() ���Ӿ����������仯
���Ӿ����������仯
C. ![]() ��ԭ�Ӿ����
��ԭ�Ӿ����![]() ���Ӿ��������ͬ���������ʺͻ�ѧ����
���Ӿ��������ͬ���������ʺͻ�ѧ����
D. ��![]() ��ԭ�Ӿ����У�ÿһ��Cԭ����Χ���4��Oԭ�ӣ�ÿһ��Oԭ�Ӹ�����Cԭ������
��ԭ�Ӿ����У�ÿһ��Cԭ����Χ���4��Oԭ�ӣ�ÿһ��Oԭ�Ӹ�����Cԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ������ȤС��Ϊ̽��ͭ��Ũ����ķ�Ӧ���������ͼ��ʾװ�ý����й�ʵ�飺

(1)B�������ռ�ʵ���в����������װ�ã���δ�����ܻ�ȫ������ͼ�ϰѵ��ܲ�������_________��
(2)ʵ��������ȡ6.4 gͭƬ��12 mL 18 mol��L1Ũ�������Բ����ƿ�й��ȣ�ֱ����Ӧ��ϣ��������ƿ�л���ͭƬʣ�࣬��С��ѧ��������ѧ�Ļ�ѧ֪ʶ��Ϊ����һ����������ʣ�ࡣ
��д��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��__________________��
��Ϊʲô��һ���������ᵫδ��ʹͭƬ��ȫ�ܽ⣬����Ϊԭ����__________________��
������ҩƷ���ܹ�����֤����Ӧ���������ƿ��ȷ���������________(����)��
A������ B��BaCl2��Һ C������ D��Na2CO3��Һ
(3)װ��C���Թ�D��ʢװ����Ʒ����Һ����B�������ռ������п��ܹ۲쵽��������_____________������Ӧ��������C���ձ��ڼ����ˮ��D�й۲쵽��������_____________��
(4)ʵ��װ��C�п�����ɻ�����Ⱦ��������ķ������Խ����__________________(ʵ����Ʒ��ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ⶨ����þ�����ԭ����������������ͼ�������������һ��ʵ��װ��(ÿ������ֻ��ʹ��һ�Σ��������������ɿ�����״���µ����)��

������(����������)��
(1)�����������ӵ��Ⱥ�˳����__________��________��________��________��________��________��________��________(��Сд��ĸ��ʾ)��
(2)���Ӻ�������Ҫ���еIJ��������¼��������Ⱥ�˳����________________(�����)��
�ٴ�����B�е��¶Ȼָ�������ʱ�������ͲC��ˮ�����ΪVa mL��
�ڲ���þ�����������Ĥ������������ƽ�ϳ�����������Ϊm g��������Ͷ���Թ�B�еĴ������ϣ�
�ۼ��װ�õ������ԣ�
������װ��A�Ϸ�Һ©���Ļ�����ʹ��ˮ˳�����£���þ��ȫ�ܽ�ʱ�ٹر������������ʱA�й�����ˮVb mL��
(3)����ʵ�����ݿ��������þ�����ԭ������������ѧ����ʽΪ___________________��
(4)���Թ�B���¶�δ��ȴ�����£��Ͷ�����ͲC��ˮ��������⽫��ʹ���ⶨþ�����ԭ����������________(�ƫ��ƫС������Ӱ�족)��
(5)��ϸ��������ʵ��װ�ú�������Ϊ������������������������ͼ��ʾ��ʵ��װ�á�

��װ���е���a��������_________________________________________��
��ʵ��ǰ���ʽ�ζ�����Һ������ֱ�ΪV1 mL��V2 mL����������������Ϊ____________mL��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧ����������װ��̽�������백��֮��ķ�Ӧ������CΪ��������������백����Ӧ��װ�á���ش��������⣺
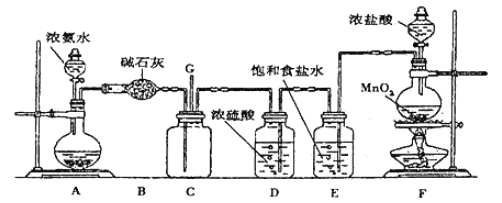
��1��װ��A�е���ƿ�ڹ��岻��ѡ��_____________��
A����ʯ�� B����ʯ��
C������������ D���ռ�
��2��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ________________________��
��3��Bװ�õ�����_____________��Eװ�õ�����_____________��
��4��װ��C�ڳ���Ũ��İ��̲��������ڱ����ᣬ��һ�������ǿ�������Ҫ�ɷ�֮һ��д����Ӧ�Ļ�ѧ����ʽ��___________��
��5����װ��C��G���ݳ���β���п��ܺ��л���ɫ���ж����壬��Ҫ������д�����ӷ���ʽ________________��
ʵ�����Ʊ����������з���������ѡ�õ���________________________��
�ٹ�̬�Ȼ�識��ȷֽ�
��Ũ��ˮ�м��������������
�ۼ���Ũ��ˮ
�ܹ�̬�Ȼ�����������ƻ�ϼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ���л�����ԭ�ϣ������Ҵ���ˮ�Ʊ����漰��Ӧ���£�
��2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) ��H1=��23.9 kJmol-1
CH3OCH3(g)+ H2O(g) ��H1=��23.9 kJmol-1
��2CH3OH(g)![]() C2H4(g)+2H2O(g) ��H2= ��29.1kJmol-1
C2H4(g)+2H2O(g) ��H2= ��29.1kJmol-1
��CH3CH2OH(g)![]() CH3OCH3(g) ��H3= +50.7kJmol-1
CH3OCH3(g) ��H3= +50.7kJmol-1
��C2H5OH(g)![]() C2H4(g)+ H2O(g) ��H4=akJmol-1
C2H4(g)+ H2O(g) ��H4=akJmol-1
�ش��������⣺
(1)a=___________��
(2)��1.0L�ܱ������з���0.10 mol C2H5OH(g)����һ���¶��½��Тܷ�Ӧ����Ӧʱ��(t)��������������ѹǿ(P)�����ݼ��±���
ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
��ѹǿP/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
�������C2H5OH��ƽ��ת���ʣ�Ӧ��ȡ�Ĵ�ʩΪ___________(����ĸ)��
a.�����¶� b.����ѹǿ
c.ͨ���Ҵ� d.����ѹǿ
������ѹǿP����ʼѹǿP0���㷴Ӧ��C2H5OH��ת����(C2H5OH)�ı���ʽΪ_________��ƽ��ʱC2H5OH��ת����Ϊ_______(���������λ��Ч���֣���ͬ)���÷�Ӧ��ƽ�ⳣ��K=_________��
������ѹǿP����ʼѹǿP0��ʾ��Ӧ��ϵ�������ʵ���n(��)�ͷ�Ӧ��C2H5OH���� �ʵ���n(C2H5OH)��n(��)=_____mol��n(C2H5OH)=_____mol��
(3)�±�Ϊ��Ӧ���з�Ӧ��Ũ���뷴Ӧʱ������ݣ������÷�Ӧ��c(C2H5OH)�仯��ʱ����(��t)�Ĺ��ɣ��ó��Ľ�����______���ɴ˹����Ƴ���Ӧ��12hʱc(C2H5OH)����______molL-1
��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�Ӧ��2SO2��O2![]() 2SO3(g)����������������ʱ��ֻ�ı�һ����Ӧ������������SO3�ķ�Ӧ���ʵı仯�����±��ո���(��������������С������������)��
2SO3(g)����������������ʱ��ֻ�ı�һ����Ӧ������������SO3�ķ�Ӧ���ʵı仯�����±��ո���(��������������С������������)��
��� | �ı������ | ����SO3���� |
�� | �����¶� | ________ |
�� | �����¶� | ________ |
�� | ��������Ũ�� | ________ |
�� | ʹ�ô��� | ________ |
�� | ѹ����� | ________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������С����������������Ч�ʸߣ��ڵ��������й㷺Ӧ����������ȡ�Ӧ����Դ����������ȴ��ܷ��档Na-S��صĽṹ����ͼ��ʾ����ط�ӦΪ2Na+![]() S8=Na2Sn������˵������ȷ���ǣ� ��
S8=Na2Sn������˵������ȷ���ǣ� ��
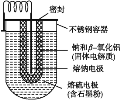
A. ���Ƶ缫����صĸ���B. �ŵ�ʱNa+�������ƶ�
C. ���ʱ���Ƶ缫���Դ����������D. ���ʱ������ӦʽΪ8Sn2--16e-=nS8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��10�£��й���ѧ����������Ϊ���������Ϳ�űҩ���������أ����ŵ��������ѧ��ҽѧ���������ؿ�����éȩΪԭ����ȡ������˵������ȷ���ǣ� ��
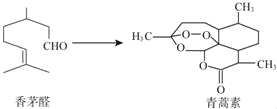
A����éȩ��ʹBr2��CCl4��Һ��ɫ
B�������ط���ʽΪC15H22O5
C����������һ�������¿ɷ���ˮ�ⷴӦ
D�����߾��������������ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com