
【题目】对于反应:2SO2+O2![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3速率 |
① | 升高温度 | ________ |
② | 降低温度 | ________ |
③ | 增大氧气浓度 | ________ |
④ | 使用催化剂 | ________ |
⑤ | 压缩体积 | ________ |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
②pH=11的溶液中:CO32-、Na+、NO3-、S2-、K+
③水电离的H+浓度为10-12 molL-1的溶液中:NH4+、Na+、SO42-、HCO3-
④加入Mg能放出H2的溶液中:Mg2+、NO3-、NH4+、K+、S2O32-
⑤澄清溶液中:Na+、HCO3-、K+、AlO2-、SO42-
⑥![]() =1×10-12的溶液中:K+、Na+、CO32-、NO3-
=1×10-12的溶液中:K+、Na+、CO32-、NO3-
⑦水溶液中:K+、SO42-、NH4+、NO3-、HCO3-
A.①③⑤⑦B.①④⑤⑥C.②④⑤⑥D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量X气体通入Y溶液中,实验结果与预测现象一致的组合是( )
X气体 | Y溶液 | 预测现象 |
| |
① | CO2 | Na2SiO3溶液 | 有白色沉淀产生 | |
② | SO2 | BaCl2溶液 | 有白色沉淀产生 | |
③ | Cl2 | AgNO3溶液 | 有白色沉淀产生 | |
④ | NH3 | AlCl3溶液 | 有白色沉淀产生 |
A.只有①②③B.只有①②④
C.只有①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷与氧气反应过程中的能量变化如下图所示。下列有关说法中正确的是
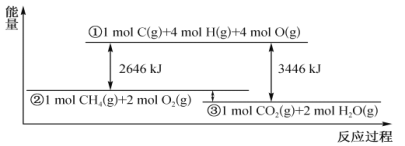
A. 反应 CO2(g)+2H2O(l)==CH4(g)+2O2(g) △H<0
B. 若将1mol CO2(g)、2 molH2O(l)的能量标在图中,则其位置在①、②之间
C. 若C一H键的键能为415kJ mol-1,则O= O的键能为493 kJ mol-1
D. 若该反应过程中转化的化学能为200kJ,则有0.25 molC=O生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是一种治疗胃及十二指肠溃疡、反流性或糜烂性食管炎等的药物,G 的一种合成路线如下:
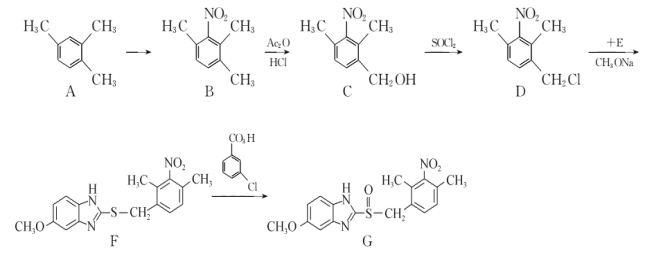
回答下列问题:
(1)A的化学名称为____________,C中所含官能团名称为____________。
(2)C生成D的反应类型为____________,F生成G的反应类型为____________。
(3)由A生成B的化学方程为____________。
(4)E的分子式为C8H8ON2S,其结构简式为____________。
(5)芳香化合物W是C的同分异构体。满足下列条件的W共有_________种(不含立体异构)。
①W分子中含氨基、羧基和羟基三种官能团
②苯环上只有两个取代基
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示有6种不同化学环境的氢的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给你提供纯锌、纯铜片和500 mL 0.2 mol·L-1的H2SO4溶液、导线、1000 mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。

(1)如图所示,装置气密性良好,且1000 mL量筒中已充满了水,则开始实验时,a电极材料为________,其电极反应式为________。b电极材料为________,其电极反应式为________。
(2)当量筒中收集到672 mL气体时(已折算到标准状况下),通过导线的电子的物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400 ℃时,将一定量的SO2和14 mol O2压入一个盛有催化剂的10 L密闭容器中进行反应:2SO2+O2![]() 2SO3,已知2 min后,容器中剩余2 mol SO2和12 mol O2。试计算:
2SO3,已知2 min后,容器中剩余2 mol SO2和12 mol O2。试计算:
(1)生成SO3的物质的量__________________。
(2)SO2的起始物质的量浓度____________________。
(3)2 min内SO2和SO3的反应速率______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。
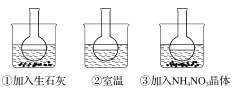
(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为______________(用离子方程式解释)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____________(填字母)。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为__________、___________、__________。(填“左”、“右”或“不移动”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的反应原理和实验装置如下:
![]() +HO—NO2
+HO—NO2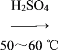
![]() +H2O ΔH<0
+H2O ΔH<0
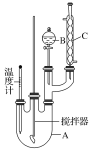
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18g。回答下列问题:
(1)装置A的名称是______,装置C的作用是____________。
(2)配制混合液时,_____(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:________________。
(3)为了使反应在50~60℃下进行,常用的方法是_______。
(4)在洗涤操作中,第二次水洗的作用是________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是__________。
(6)本实验所得到的硝基苯产率是_____(结果保留2位有效数字,已知硝酸过量)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com