
【题目】有机化合物G是一种治疗胃及十二指肠溃疡、反流性或糜烂性食管炎等的药物,G 的一种合成路线如下:
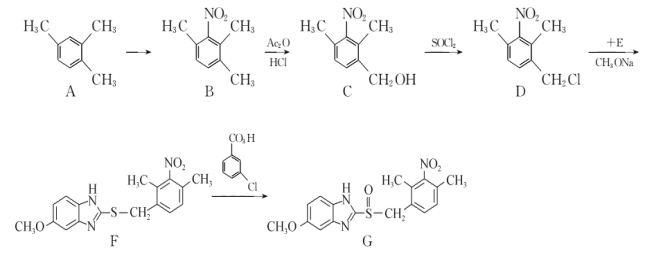
回答下列问题:
(1)A的化学名称为____________,C中所含官能团名称为____________。
(2)C生成D的反应类型为____________,F生成G的反应类型为____________。
(3)由A生成B的化学方程为____________。
(4)E的分子式为C8H8ON2S,其结构简式为____________。
(5)芳香化合物W是C的同分异构体。满足下列条件的W共有_________种(不含立体异构)。
①W分子中含氨基、羧基和羟基三种官能团
②苯环上只有两个取代基
③能与FeCl3溶液发生显色反应
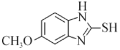
其中核磁共振氢谱显示有6种不同化学环境的氢的结构简式为_______________________。
【答案】1,2,4-三甲基苯 硝基、羟基 取代反应 氧化反应 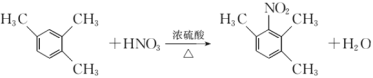
 12
12 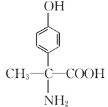
【解析】
E的分子式为C8H8ON2S,根据D和F的结构简式,可以推知E的结构简式为 ,结合官能团的结构和性质分析解答(1)~(4);
,结合官能团的结构和性质分析解答(1)~(4);
(5)芳香化合物W是C的同分异构体,W中含有苯环,①W分子中含氨基、羧基和羟基三种官能团;②苯环上只有两个取代基;③能与FeCl3溶液发生显色反应,说明含有酚羟基,结合C的结构简式分析判断符合条件的W苯环上的2个侧链,据此分析判断W的同分异构体数目,并从中找到核磁共振氢谱显示有6种不同环境的氢的结构简式。
(1)A(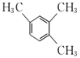 )的名称为1,2,4-三甲基苯,C(
)的名称为1,2,4-三甲基苯,C(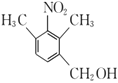 )中含有的官能团有硝基和羟基,故答案为:1,2,4-三甲基苯;硝基和羟基;
)中含有的官能团有硝基和羟基,故答案为:1,2,4-三甲基苯;硝基和羟基;
(2)C到D的反应是C中的羟基被氯原子取代,发生的是取代反应;F到G的过程中,G中多了一个氧,加氧或去氢的有机反应是氧化反应,故答案为:取代反应;氧化反应;
(3)A到B是硝化反应,反应的方程式为 ,故答案为:
,故答案为: ;
;
(4)E的分子式为C8H8ON2S,根据D和F的结构简式,可以推知E的结构简式为 ,故答案为:
,故答案为: ;
;
(5)C为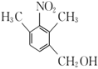 ,芳香化合物W是C的同分异构体,W中含有苯环,①W分子中含氨基、羧基和羟基三种官能团;②苯环上只有两个取代基;③能与FeCl3溶液发生显色反应,说明含有酚羟基,符合条件的W苯环上的2个侧链分别为:羟基和
,芳香化合物W是C的同分异构体,W中含有苯环,①W分子中含氨基、羧基和羟基三种官能团;②苯环上只有两个取代基;③能与FeCl3溶液发生显色反应,说明含有酚羟基,符合条件的W苯环上的2个侧链分别为:羟基和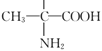 ;羟基和
;羟基和![]() ;羟基和
;羟基和![]() ;羟基和
;羟基和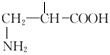 ,2个侧链在苯环上均存在邻位、间位和对位3种,共有12种同分异构体,其中核磁共振氢谱显示有6种不同环境的氢的结构简式为
,2个侧链在苯环上均存在邻位、间位和对位3种,共有12种同分异构体,其中核磁共振氢谱显示有6种不同环境的氢的结构简式为 ,故答案为:12;
,故答案为:12; 。
。


科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.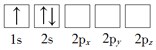 B.
B.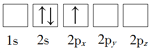
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
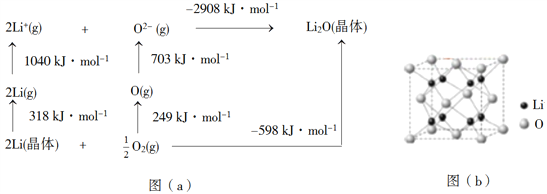
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应。其中C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
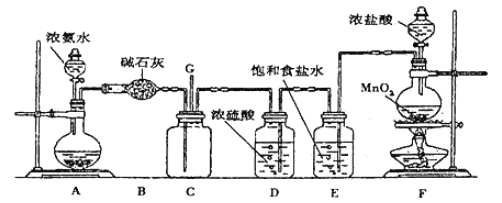
(1)装置A中的烧瓶内固体不能选用_____________。
A.生石灰 B.碱石灰
C.五氧化二磷 D.烧碱
(2)装置A中发生反应的化学方程式为________________________。
(3)B装置的作用_____________;E装置的作用_____________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。写出反应的化学方程式:___________。
(5)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,需要处理,写出离子方程式________________;
实验室制备氨气,下列方法中适宜选用的是________________________。
①固态氯化铵加热分解
②浓氨水中加入固体氢氧化钠
③加热浓氨水
④固态氯化铵与氢氧化钙混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是原电池,电池总反应为Mg+ClO-+H2O=Cl-+ Mg(OH)2,图乙是电解池,用于含Cr2O72-的工业废水的处理。下列说法错误的是
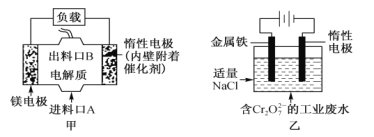
A. 图甲中发生的氧化反应是Mg—2e-=Mg2+
B. 图乙中惰性电极作电解池的阴极,电极棒上有H2放出
C. 图乙中Cr2O72-向惰性电极移动,该极附近有Cr(OH)3生成
D. 若图甲作为图乙的电源,当消耗3.6g镁时,理论上也消耗8.4g铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2SO2+O2![]() 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入下表空格内(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3速率 |
① | 升高温度 | ________ |
② | 降低温度 | ________ |
③ | 增大氧气浓度 | ________ |
④ | 使用催化剂 | ________ |
⑤ | 压缩体积 | ________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
①I2(g)+H2(g)![]() 2HI(g) △H=-9.48kJmol-1
2HI(g) △H=-9.48kJmol-1
②I2(s)+H2(g)![]() 2HI(g)△H=+26.48kJmol-1,下列判断正确的是
2HI(g)△H=+26.48kJmol-1,下列判断正确的是
A.反应①的产物比反应②的产物稳定
B.254g I2(g)中通入2g H2(g),反应放热9.48kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明Cl的非金属性比S的非金属性强的事实是( )
A.Cl2与H2反应生成HCl,而S与H2反应生成H2S
B.Cl原子最外电子层上有7个电子,而S原子最外层上有6个电子
C.Cl2 能与水反应而S不与水反应
D.向H2S 的水溶液中通入Cl2可得到淡黄色的固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)写出元素符号和名称:
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑤的氧化物跟④的氢氧化物溶液反应:________________________________
⑥的单质在③的单质中燃烧:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com