
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.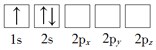 B.
B.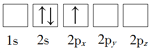
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
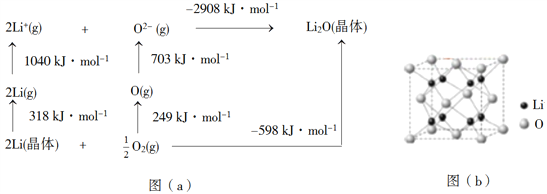
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
【答案】 D C Li+核电荷数较大 正四面体 sp3 AB 520 498 2908 ![]()
【解析】分析:(1)根据处于基态时能量低,处于激发态时能量高判断;
(2)根据原子核对最外层电子的吸引力判断;
(3)根据价层电子对互斥理论分析;根据物质的组成微粒判断化学键;
(4)第一电离能是气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,据此计算;根据氧气转化为氧原子时的能量变化计算键能;晶格能是气态离子形成1摩尔离子晶体释放的能量,据此解答;
(5)根据晶胞中含有的离子个数,结合密度的定义计算。
详解:(1)根据核外电子排布规律可知Li的基态核外电子排布式为1s22s1,则D中能量最低;选项C中有2个电子处于2p能级上,能量最高;
(2)由于锂的核电荷数较大,原子核对最外层电子的吸引力较大,因此Li+半径小于H-;
(3)LiAlH4中的阴离子是AlH4-,中心原子铝原子含有的价层电子对数是4,且不存在孤对电子,所以空间构型是正四面体,中心原子的杂化轨道类型是sp3杂化;阴阳离子间存在离子键,Al与H之间还有共价单键,不存在双键和氢键,答案选AB;
(4)根据示意图可知Li原子的第一电离能是1040 kJ/mol÷2=520 kJ/mol;0.5mol氧气转化为氧原子时吸热是249 kJ,所以O=O键能是249 kJ/mol×2=498 kJ/mol;根据晶格能的定义结合示意图可知Li2O的晶格能是2908 kJ/mol;
(5)根据晶胞结构可知锂全部在晶胞中,共计是8个,根据化学式可知氧原子个数是4个,则Li2O的密度是![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆—氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是

A. 有O2放电的a极为电池的负极
B. O2-移向电池的正极
C. b极对应的电极反应为2H2-4e-+2O2-=2H2O
D. a极对应的电极反应为O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因存在浓度差而产生电动势的电池称为浓差电池。利用如图所示装置进行实验,开始先闭合K2,断开Kl,电解一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。下列说法不正确的是
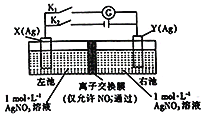
A.闭合K2,断开Kl,NO3-从左池向右池移动
B.断开K2,闭合K1,X为正极
C.闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
D.装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
(1)A中所有碳原子都处于同一直线上,则A的结构简式为_____________。
(2)B的名称是_____________。
(3)反应①~④中,属于加成反应的有_____________,反应⑥~⑨中,属于氧化反应的有_____________。
(4)请写出反应⑥的化学方程式为_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式为_____________。
结构片段,请写出反应⑩的化学方程式为_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸(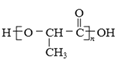 )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程_____________。
(R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )
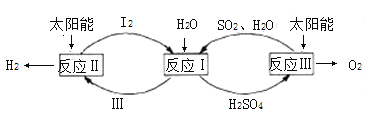
A.反应过程中化合价改变的元素共有H、O、S
B.涉及的反应类型有分解反应和化合反应,且步骤Ⅲ是HI的分解
C.理论上,每生成16gO2,就能得到标准状况下22.4LH2
D.理论上,每分解18gH2O,就需向体系内再补充32gSO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是( )
①pH=7的溶液中:Fe3+、Cl-、Na+、NO3-
②pH=11的溶液中:CO32-、Na+、NO3-、S2-、K+
③水电离的H+浓度为10-12 molL-1的溶液中:NH4+、Na+、SO42-、HCO3-
④加入Mg能放出H2的溶液中:Mg2+、NO3-、NH4+、K+、S2O32-
⑤澄清溶液中:Na+、HCO3-、K+、AlO2-、SO42-
⑥![]() =1×10-12的溶液中:K+、Na+、CO32-、NO3-
=1×10-12的溶液中:K+、Na+、CO32-、NO3-
⑦水溶液中:K+、SO42-、NH4+、NO3-、HCO3-
A.①③⑤⑦B.①④⑤⑥C.②④⑤⑥D.②⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2) 写出C元素基态原子的电子排布式_________________________。
(3)写出D元素原子的价电子排布图____________________。
(4) 元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是
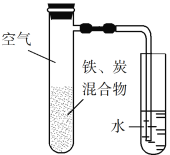
A. 铁被氧化的电极反应式为Fe3e![]() Fe3+
Fe3+
B. 铁腐蚀过程中化学能全部转化为电能
C. 活性炭的存在会加速铁的腐蚀
D. 以水代替NaCl溶液,铁不能发生吸氧腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是一种治疗胃及十二指肠溃疡、反流性或糜烂性食管炎等的药物,G 的一种合成路线如下:
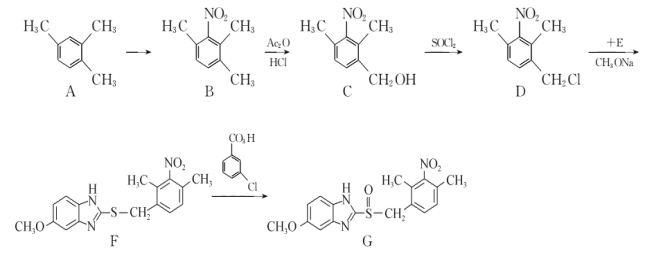
回答下列问题:
(1)A的化学名称为____________,C中所含官能团名称为____________。
(2)C生成D的反应类型为____________,F生成G的反应类型为____________。
(3)由A生成B的化学方程为____________。
(4)E的分子式为C8H8ON2S,其结构简式为____________。
(5)芳香化合物W是C的同分异构体。满足下列条件的W共有_________种(不含立体异构)。
①W分子中含氨基、羧基和羟基三种官能团
②苯环上只有两个取代基
③能与FeCl3溶液发生显色反应
其中核磁共振氢谱显示有6种不同化学环境的氢的结构简式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com