
【题目】分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )
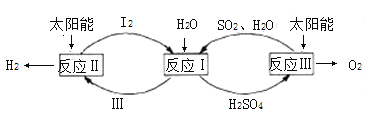
A.反应过程中化合价改变的元素共有H、O、S
B.涉及的反应类型有分解反应和化合反应,且步骤Ⅲ是HI的分解
C.理论上,每生成16gO2,就能得到标准状况下22.4LH2
D.理论上,每分解18gH2O,就需向体系内再补充32gSO2
【答案】C
【解析】
反应I:SO2+2H2O+I2=H2SO4+2HI;
反应II:2HI![]() H2↑+I2;
H2↑+I2;
反应III:2H2SO4![]() 2SO2↑+2H2O+O2↑;
2SO2↑+2H2O+O2↑;
A、根据反应方程式可以看出,反应I中S和I化合价改变。反应II中H和I化合价改变。反应III中S和O化合价改变,所以过程中化合价改变的是H、O、S、I,故A错误;
B、反应II和III都是分解反应,而反应I不是基本反应类型,故B错误;
C、整个过程是碘和二氧化硫做催化剂,在太阳能的作用下水分解成氢气和氧气,所以生成16g氧气就生成2g氢气,标准状况下,氢气的体积为22.4L,故C正确;
D、根据上述反应可知,二氧化硫是催化剂,所以质量在过程中不会减少,不需要向体系内再补充二氧化硫,故D错误;
故选C。


 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】(1)在2L的密闭容器中放入4molN2O5,发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
4NO2(g)+O2(g)。反应至5min时,测得N2O5转化了20%,则v(NO2)为___,c(N2O5)为___,O2的物质的量浓度为___。
(2)某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。根据图中数据填空:

①该反应的化学方程式为___。
②反应至平衡时,v(X)为___,c(Z)为___。
③若X、Y、Z均为气体,则达平衡时,容器内混合气体的平均相对分子质量比起始投料时___(填“增大”“减小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳足量,反应C(s)+H2O(g)![]() CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加碳的量且表面积保持不变 ②将容器的体积缩小一半 ③保持体积不变,充入He,使体系压强增大 ④保持压强不变,充入He使容器体积变大
A.①④B.②③C.①③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中不正确的是( )
A.分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B.28g乙烯和丙烯(C3H6)的混合气体中含有的碳原子数为2NA
C.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D.常温常压下,22.4L氯气与足量H2充分反应 ,生成HCl的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。
A.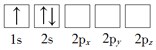 B.
B.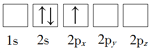
C.![]() D.
D.![]()
(2)Li+与H具有相同的电子构型,r(Li+)小于r(H),原因是______。
(3)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是______、中心原子的杂化形式为______。LiAlH4中,存在_____(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
(4)Li2O是离子晶体,其晶格能可通过图(a)的BornHaber循环计算得到。
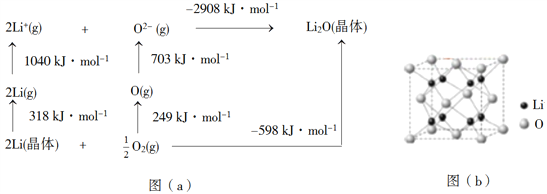
可知,Li原子的第一电离能为________kJ·mol1,O=O键键能为______kJ·mol1,Li2O晶格能为______kJ·mol1。
(5)Li2O具有反萤石结构,晶胞如图(b)所示。已知晶胞参数为0.4665 nm,阿伏加德罗常数的值为NA,则Li2O的密度为______g·cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
⑴在这些元素中,最活泼的非金属元素是___________,化学性质最不活泼的元素是______________。
⑵表中金属性最强的元素是_______________,其原子结构示意图为 _______________________ 。
⑶表中元素的最高价氧化物对应的水化物中酸性最强的是__________,呈两性的氢氧化物是______。
⑷元素⑩的元素符号为 ____________ ,元素⑦的原序数为_________。
⑸在①~③元素中,原子半径最大的是_____________,原子半径最小的是_____________。
⑹十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列有关说法正确的是
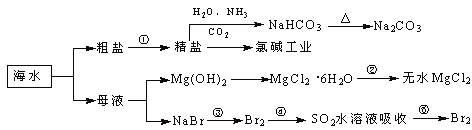
A. 过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B. 用澄清的石灰水可鉴别NaHCO3和Na2CO3
C. 过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学在日常生活中用途广泛,图甲是原电池,电池总反应为Mg+ClO-+H2O=Cl-+ Mg(OH)2,图乙是电解池,用于含Cr2O72-的工业废水的处理。下列说法错误的是
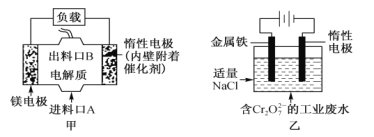
A. 图甲中发生的氧化反应是Mg—2e-=Mg2+
B. 图乙中惰性电极作电解池的阴极,电极棒上有H2放出
C. 图乙中Cr2O72-向惰性电极移动,该极附近有Cr(OH)3生成
D. 若图甲作为图乙的电源,当消耗3.6g镁时,理论上也消耗8.4g铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com