
【题目】碳足量,反应C(s)+H2O(g)![]() CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一个可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加碳的量且表面积保持不变 ②将容器的体积缩小一半 ③保持体积不变,充入He,使体系压强增大 ④保持压强不变,充入He使容器体积变大
A.①④B.②③C.①③D.②④
科目:高中化学 来源: 题型:
【题目】某研究小组利用如图所示的装置,进行CO还原Fe2O3的实验(固定装置略)。
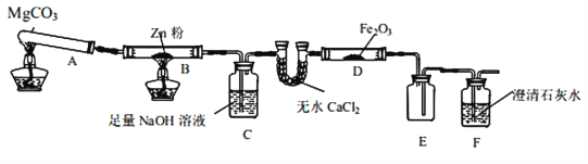
(1)装置B中发生的化学方程式________________。装置C的作用是__________________________
(2)用酒精喷灯对装置D加热,得到灰黑色粉末用黑色粉末进行以下实验:
步骤 | 操作 | 现象 |
1 | 取灰黑色粉末加入稀硫酸 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加NaOH溶液后,在空气中,搅拌放置 | 白色沉淀最终变为红褐色 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水至过量 | 先变红,后褪色 |
①得到的灰黑色粉末是________________(填写化学式)。
②步骤2中“白色沉淀最终变为红褐色”的化学反应方程式为_________________。
③步骤4中,溶液变红的原因为_____________________________________________________________;溶液褪色可能的原因______________________________________;验证上述原因的实验操作方法为____________。
(3)上述装置,从实验安全考虑,需要采取的改进措施是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO)制备草酸镍晶体(NiC2O4·2H2O)的流程如下:
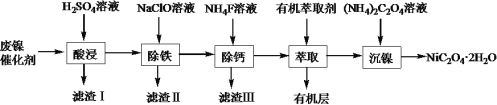
(1)NiC2O4·2H2O中C的化合价是______。既能加快“酸浸”反应速率又能提高“酸浸”原料利用率的操作措施为_____________。
(2)“滤渣Ⅰ”的主要成分是_____________。若控制温度为80℃、pH=2时,“除铁”产生的“滤渣Ⅱ”的主要成分为黄钠铁矾(Na2Fe6(SO4)4(OH)12),写出生成黄钠铁矾沉淀的离子方程式:__________________。
(3)已知“滤渣Ⅲ”的主要成分为CaF2,则“萃取”操作中加入有机萃取剂的作用是__________。
(4)在隔绝空气的条件下,高温煅烧无水NiC2O4得到Ni2O3和两种含碳元素的气体,该反应的化学方程式是_________。
(5)高能锂离子电池的总反应为2Li + FeS = Fe + Li2S。用该电池作电源电解含镍酸性废水回收Ni的装置如图(图中X、Y为电极,LiPF6·SO(CH3)2为电解质)。
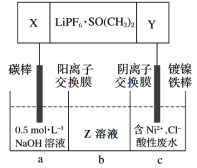
①电极X的反应材料是_________(填化学式);中间隔室b可以得到的主要物质Z是_________(填化学式)。
②电解总反应的离子方程式为_________。已知F=96500C/mol,若电池工作t min,维持电流强度为I A,理论回收Ni_________g(写出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因存在浓度差而产生电动势的电池称为浓差电池。利用如图所示装置进行实验,开始先闭合K2,断开Kl,电解一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。下列说法不正确的是
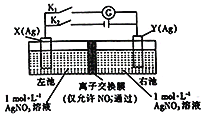
A.闭合K2,断开Kl,NO3-从左池向右池移动
B.断开K2,闭合K1,X为正极
C.闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
D.装置安装后若直接闭合Kl,电流计指针不发生偏转,但往左池加入适当的氨水后,指针偏转
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C(又名抗坏血酸,分子式为C6H8O6)具有较强的还原性,放置在空气中易被氧化,其含量可用已知浓度的标准I2溶液进行滴定(弱酸性性环境)。该反应的化学方程式为:C6H8O6+I2 = C6H6O6+2HI具体测定步骤及测得数据如下:取10 mL 6 mol·L-1CH3COOH溶液,加入100 mL蒸馏水,将溶液加热煮沸后冷却。精确称取0.2000 g样品,溶解于上述冷却的溶液中,加入1mL指示剂,立即用浓度为0.0500 mol·L-1的标准I2溶液进行滴定到终点,消耗21.00 mL I2溶液。
(1)实验中的指示剂是____________确定达到滴定终点的现象是_____________。
(2)盛装标准I2溶液的是_________(酸式或碱式)滴定管,若滴定结束时俯视滴定管读数(其它操作正确)则滴定结果_______(偏高、偏低或无影响)。
(3)加入的CH3COOH稀溶液要先经煮沸、冷却后才能使用,其目的是_____________。
(4)计算样品中维生素C的质量分数____________(要求列式,且式中各物理量带单位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料尼龙66具有良好的抗冲击性、韧性、耐燃油性和阻燃、绝缘等特点,因此广泛应用于汽车、电气等工业中。以下是生产尼龙66的一些途径。
(1)A中所有碳原子都处于同一直线上,则A的结构简式为_____________。
(2)B的名称是_____________。
(3)反应①~④中,属于加成反应的有_____________,反应⑥~⑨中,属于氧化反应的有_____________。
(4)请写出反应⑥的化学方程式为_____________。
(5)高分子材料尼龙66中含有![]() 结构片段,请写出反应⑩的化学方程式为_____________。
结构片段,请写出反应⑩的化学方程式为_____________。
(6)某聚合物K的单体与A互为同分异构体,该单体核磁共振氢谱有三个峰,峰面积之比为1:2:3,且能与NaHCO3溶液反应,则聚合物K的结构简式是_____________。
(7)聚乳酸(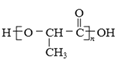 )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应: (R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程_____________。
(R′可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分解水制氢的一种原理如图,下列关于该原理的说法正确的是( )
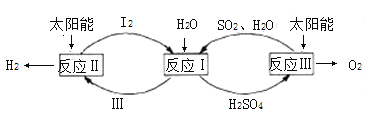
A.反应过程中化合价改变的元素共有H、O、S
B.涉及的反应类型有分解反应和化合反应,且步骤Ⅲ是HI的分解
C.理论上,每生成16gO2,就能得到标准状况下22.4LH2
D.理论上,每分解18gH2O,就需向体系内再补充32gSO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2) 写出C元素基态原子的电子排布式_________________________。
(3)写出D元素原子的价电子排布图____________________。
(4) 元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2![]() HCOONa+H2O下列有关说法正确的是
HCOONa+H2O下列有关说法正确的是
A. 储氢、释氢过程均无能量变化
B. NaHCO3、HCOONa均含有离子键和共价键
C. 储氢过程中,NaHCO3被氧化
D. 释氢过程中,每消耗0.1molH2O放出2.24L的H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com