
����Ŀ����ҵ�����÷�����������Ҫ�ɷ�ΪNi��������һ������Zn��Fe��SiO2��CaO���Ʊ����������壨NiC2O4��2H2O�����������£�
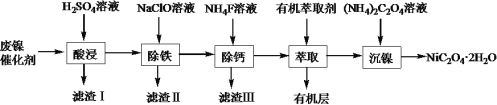
��1��NiC2O4��2H2O��C�Ļ��ϼ���______�����ܼӿ����������Ӧ������������������ԭ�������ʵIJ�����ʩΪ_____________��
��2����������������Ҫ�ɷ���_____________���������¶�Ϊ80����pH=2ʱ���������������ġ�������������Ҫ�ɷ�Ϊ����������Na2Fe6(SO4)4(OH)12����д�����ɻ����������������ӷ���ʽ��__________________��
��3����֪����������Ҫ�ɷ�ΪCaF2������ȡ�������м����л���ȡ����������__________��
��4���ڸ��������������£�����������ˮNiC2O4�õ�Ni2O3�����ֺ�̼Ԫ�ص����壬�÷�Ӧ�Ļ�ѧ����ʽ��_________��
��5����������ӵ�ص��ܷ�ӦΪ2Li + FeS = Fe + Li2S���øõ������Դ��⺬�����Է�ˮ����Ni��װ����ͼ��ͼ��X��YΪ�缫��LiPF6��SO(CH3)2Ϊ����ʣ���
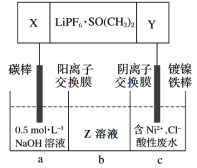
�ٵ缫X�ķ�Ӧ������_________���ѧʽ�����м����b���Եõ�����Ҫ����Z��_________���ѧʽ����
�ڵ���ܷ�Ӧ�����ӷ���ʽΪ_________����֪F��96500C/mol������ع���t min��ά�ֵ���ǿ��ΪI A�����ۻ���Ni_________g��д���������ʽ���ɣ���
���𰸡�+3 ��������Ũ�� SiO2��CaSO4 6Fe2��3ClO��2Na����4SO42��9H2O=Na2Fe6(SO4)4(OH)12����3Cl����6H�� ��ȥ��Һ�е�Zn2�� 2NiC2O4![]() Ni2O3+3CO��+CO2�� FeS NaCl 4OH-+2Ni2+
Ni2O3+3CO��+CO2�� FeS NaCl 4OH-+2Ni2+![]() O2��+2Ni+2H2O
O2��+2Ni+2H2O ![]()
��������
��������(��Ҫ�ɷ�ΪNi��������һ������Zn��Fe��SiO2��CaO��)���������ܽ⣬SiO2�������ᷴӦ�����˵õ���Һ�к���NiSO4��FeSO4��ZnSO4��CaSO4�����������ᣬ����IΪSiO2��CaSO4�����Һ�м���������ƣ���Fe2+����ΪFe3+��ͬʱ����pH��ʹFe3+ת��ΪFe(OH)3��������������IIΪ��Ԫ�صij�������Һ�к���NiSO4��CaSO4������Һ�м���NH4F����ȥCa2+�����ˣ��ټ��л���ȡ����ȥ��Һ�е�Zn2+��������Һ�м���(NH4)2C2O4���õ��������������ٹ��ˡ�ϴ�ӡ�����ò��������壬�ݴ˷�����
��1��NiC2O4��2H2O����Ϊ+2�ۣ���Ϊ-2�ۣ�HΪ+1�ۣ����ݻ������и�Ԫ�ػ��ϼ۴�����Ϊ0��֪��C�Ļ��ϼ���+3�ۣ�����Ӱ�컯ѧ��Ӧ���ʵ����ؿ�֪����߽����ʣ��ɰѷ�������������ʵ����ȡ��ʵ���������Ũ�ȡ�����ȣ�
��2������I�ijɷ���CaSO4��SiO2���������¶�80�桢pH=2���ɵõ���������[Na2Fe6(SO4)4(OH)12]����������������ԭ��Ӧ����д�����ɻ������Ƶ����ӷ���ʽΪ��2Na++3ClO-+6Fe2++4SO42-+9H2O=Na2Fe6(SO4)4(OH)12��+3Cl-+6H+��
��3����������ͼ��֪����������������Ҫ�ɷ�ΪCaF2��������ȡ�������м����л���ȡ���������dz�ȥ��Һ�е�Zn2����
��4���ڸ��������������£�����������ˮNiC2O4�õ�Ni2O3�����ֺ�̼Ԫ�ص����壬����Ϊһ����̼�Ͷ�����̼���ʷ�Ӧ�Ļ�ѧ����ʽ��2NiC2O4![]() Ni2O3+3CO��+CO2����
Ni2O3+3CO��+CO2����
��5���ٵ�⺬�����Է�ˮ����Ni������ͼ��c��Ϊ��ˮ����ӦΪNi2++2e-=Ni��������ԭ��Ӧ����Ϊ���ص����������ӵ�Դ�ĸ�����YΪ��Դ�ĸ�����XΪ��Դ���������缫X�ķ�Ӧ������FeS��c����Ni2+�õ��Ӳ���Ni�����������������ӽ���Ĥ����c�أ�a��������������ʧ���Ӳ����������������������ӽ���Ĥ����b�أ����м����b���Եõ�����Ҫ����Z��NaCl��
�ڵ�������缫��ӦʽΪNi2++2e-=Ni�������缫��ӦʽΪ4OH--4e-![]() O2��+2H2O���ʵ���ܷ�Ӧ�����ӷ���ʽΪ4OH-+2Ni2+
O2��+2H2O���ʵ���ܷ�Ӧ�����ӷ���ʽΪ4OH-+2Ni2+![]() O2��+2Ni+2H2O��
O2��+2Ni+2H2O��
��֪F��96500C/mol������ع���t min��ά�ֵ���ǿ��ΪI A�����ۻ���Ni ![]() g��
g��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ�ijʵ����ȤС������ʵ����ڶ��鿨Ƭ�ϼ�¼���£�������ȷ���ǣ� ��
��Zn������Cu������
��H+���ƶ���
�۵�������Zn�����·����Cu��
��Cu������H2������
������1mol�����������ߣ��������H2Ϊ0.5mol��
�������ĵ缫��ӦʽΪZn��2e���TZn2+��

A���٢ڢ� B���ۢܢ� C���ܢݢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ������У����幹����ƽ�������ε��ǣ� ��
A. CH4B. NH4+
C. NO3-D. CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£������ܱ������н��еĿ��淴ӦA��g��+3B��g��![]() 2C��g��������˵���У���˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
2C��g��������˵���У���˵����һ��Ӧ�Ѿ��ﵽ��ѧƽ��״̬���ǣ� ��
A.����B��������C�ֽ���������
B.A��B��C��Ũ�����
C.��λʱ������nmolA��ͬʱ����2nmolC
D.A��B��C�ķ�����֮��Ϊ1��3��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10L�ܱ������У�1molA��3molB��һ�������·�Ӧ��A��g��+xB��g��![]() 2C��g����2min��Ӧ�ﵽƽ��ʱ����û�����干3.4mol������0.4molC�������м���������ȷ���ǣ� ��
2C��g����2min��Ӧ�ﵽƽ��ʱ����û�����干3.4mol������0.4molC�������м���������ȷ���ǣ� ��
A.ƽ��ʱ�����ʵ�����A��B��C=2��11��4
B.xֵ����4
C.A��ת����20%
D.B��ƽ����Ӧ����Ϊ0.04mol��L-1��min-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ���ᶬ���͡���˾ƥ�ֵĽṹ��ʽ��ͼ������˵������ȷ����

A. ��ˮ�����ƶ����͵ķ�Ӧ��ȡ����Ӧ
B. ��˾ƥ�ֵķ���ʽΪC9H8O4����һ��������ˮ��ɵ�ˮ����
C. �����ͱ����ϵ�һ��ȡ������4��
D. ����NaOH��Һ��ȥ��������������ˮ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����2L���ܱ������з���4molN2O5���������·�Ӧ:2N2O5(g)![]() 4NO2(g)+O2(g)����Ӧ��5minʱ�����N2O5ת����20%����v(NO2)Ϊ___��c��N2O5��Ϊ___��O2�����ʵ���Ũ��Ϊ___��
4NO2(g)+O2(g)����Ӧ��5minʱ�����N2O5ת����20%����v(NO2)Ϊ___��c��N2O5��Ϊ___��O2�����ʵ���Ũ��Ϊ___��
��2��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��仯��������ͼ��ʾ������ͼ��������գ�

�ٸ÷�Ӧ�Ļ�ѧ����ʽΪ___��
�ڷ�Ӧ��ƽ��ʱ��v��X��Ϊ___��c��Z��Ϊ___��
����X��Y��Z��Ϊ���壬���ƽ��ʱ�������ڻ�������ƽ����Է�����������ʼͶ��ʱ___(��������������С�����������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼��������ӦC(s)+H2O(g)![]() CO(g)+H2(g)��һ���ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ�����
CO(g)+H2(g)��һ���ɱ��ݻ����ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ�����
������̼�����ұ�������ֲ��� �ڽ������������Сһ�� �۱���������䣬����He��ʹ��ϵѹǿ���� �ܱ���ѹǿ���䣬����Heʹ����������
A.�٢�B.�ڢ�C.�٢�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������зḻ��ʳƷ���������Դ��ҩ���ˮ����Դ����ͼΪ��ˮ���õIJ��ֹ��̡�
�����й�˵����ȷ����
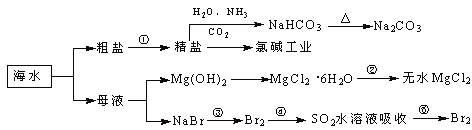
A. �������г�ȥ�����е�SO42-��Ca2����Mg2����Fe3�������ʣ������ҩƷ˳��Ϊ��Na2CO3��Һ��NaOH��Һ��BaCl2��Һ�����˺������
B. �ó����ʯ��ˮ�ɼ���NaHCO3��Na2CO3
C. �������нᾧ����MgCl2��6H2OҪ��HCl��Χ�м�����ˮ�Ƶ���ˮMgCl2
D. ��ҵ��ͨ����ⱥ��MgCl2��Һ��ȡ����þ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com