
| A. | ②④ | B. | ③ | C. | ②③ | D. | ①④ |
分析 ①金属钠投入到FeCl3溶液中,钠与水反应生成氢氧化钠,氢氧化钠与FeCl3反应生成氢氧化铁;
②过量氢氧化钠与铝铵矾反应生成偏铝酸钠、氨气和硫酸钾;
③NaAlO2溶液和NaHCO3溶液反应生成氢氧化铝和碳酸钠;
④过氧化钠与水反应生成氧气和氢氧化钠,氢氧化钠与氯化亚铁、氧气反应生成氢氧化铁沉淀.
解答 解:①金属钠投入到FeCl3溶液中,钠与水反应生成氢氧化钠和氢气,氢氧化钠与FeCl3反应生成氢氧化铁沉淀,为红褐色,不是白色,故①错误;
②过量氢氧化钠与铝铵矾反应生成偏铝酸钠、氨气和硫酸钾,不会产生沉淀,故②错误;
③NaAlO2溶液和NaHCO3溶液反应生成氢氧化铝和碳酸钠,没有气体生成,故③正确;
④过量的Na2O2投入FeCl2溶液,反应生成氧气和氢氧化铁沉淀,为红褐色沉淀,不是白色,故④错误;
故选B.
点评 本题考查了物质间的反应,为高频考点,明确物质的性质是解本题关键,根据物质的性质来分析解答,熟练掌握元素化合物之间的反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可作供氧剂,而Na2O不行 | |
| B. | 钠在常温下不容易被氧化 | |
| C. | Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 | |
| D. | 钠在氯气中燃烧,生成白色的烟雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
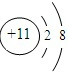 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用1g 98%的浓硫酸加入4g水配制1:4硫酸溶液 | |
| B. | 配制2.0mo1•L-1硫酸溶液时,最后在容量瓶中加水稀释到标线,塞好盖子倒转摇匀后,发现液面低于标线 | |
| C. | 在100mL无水乙醇中,加人2g甲醛配制2%的甲醛洒精溶液 | |
| D. | 在80mL水中,加入18.4mol•L-1浓硫酸20mL,配制3.68mol•L-1稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
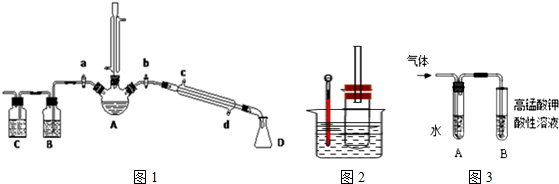
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸与0.1 mol•L-1 NaOH溶液反应:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1 | |
| B. | 氢气的标准燃烧热为285.5 kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=285.5 kJ•mol-1 | |
| C. | 密闭容器中,9.6 g硫粉与11.2 g铁粉混合加热生成硫化亚铁17.6 g时,放出19.12 kJ热量. 则Fe(s)+S(s)═FeS(s)△H=-95.6 kJ•mol-1 | |
| D. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则可知C的标准燃烧热为110.5 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com