
【题目】硫、锌在农药、材料和人们日常生活中具有广泛的应用。请回答下列问题:
(1)基态S原子中,核外电子占据的最高能级符号为______,其电子云形状为______,基态Zn原子的价电子排布式为______。
(2)硫代乙酰胺(CH3CSNH2)在酸性溶液中水解产生H2S,可替代H2S在溶液中作沉淀剂使用。1 mol CH3CSNH2含有π键为______mol,其中两个C原子的杂化方式分别为_______。
(3)H2S熔点为-85.5℃,而与其具有类似结构的H2O的熔点为0℃,极易结冰成固体,二者物理性质出现此差异的原因是____________________。
(4)ZnS可用于制白色的颜料及玻璃、发光粉、橡胶、塑料、发光油漆等。晶胞结构如图所示:

在一个ZnS晶胞结构中,S的数目为 ______。若该晶胞边长为540.0 pm,则其密度为_______gcm-3。
【答案】 3p 纺锤形 3d104s2 1 sp3、sp2 H2O分子之间极易形成氢键,而H2S分子之间只存在较弱的范德华力 4 4.1
【解析】(1)考查能级、电子云的轮廓、电子排布式,基态硫原子价电子排布式为3s23p4,电子占据的能量最高能层为M层,能级为3p,电子云轮廓图为哑铃型或纺锤形,Zn位于第四周期IIB族,锌原子价电子包括最外层电子、次外层d能级电子,即价电子排布式为:3d104s2 ;(2)考查化学键的数目,以及杂化类型的判断,CH3CSNH2的结构简式为: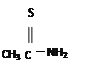 ,单键之间无π键,双键中有1个π键,因此1mol该物质种含有的π键物质的量为1mol,甲基种碳原子为sp3杂化,“C=S”中碳原子为sp2杂化;(3)考查晶体熔沸点的高低,H2S和H2O都属于分子晶体,但H2O分子间存在分子间氢键,H2S分子间不存在分子间氢键,因此有:H2O分子之间极易形成氢键,而H2S分子之间只存在较弱的范德华力;(4)考查晶胞的计算,S位于顶点和面心,个数为8×1/8+6×1/2=4,晶胞的物质的量为4/NAmol,晶胞质量为4×97/NAg,晶胞的体积为(540.0×10-10)3cm3,根据密度的定义,求出密度为 4.1。
,单键之间无π键,双键中有1个π键,因此1mol该物质种含有的π键物质的量为1mol,甲基种碳原子为sp3杂化,“C=S”中碳原子为sp2杂化;(3)考查晶体熔沸点的高低,H2S和H2O都属于分子晶体,但H2O分子间存在分子间氢键,H2S分子间不存在分子间氢键,因此有:H2O分子之间极易形成氢键,而H2S分子之间只存在较弱的范德华力;(4)考查晶胞的计算,S位于顶点和面心,个数为8×1/8+6×1/2=4,晶胞的物质的量为4/NAmol,晶胞质量为4×97/NAg,晶胞的体积为(540.0×10-10)3cm3,根据密度的定义,求出密度为 4.1。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关含高能量的正离子N5+的化合物N5AsF6的叙述正确的是( )
A.N5+与H2S是等电子体
B.N5AsF6化合物是共价分子
C.N5+中氮氮原子间以共用电子对结合
D.N5AsF6化合物是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将 0.10 molL-1的NaOH溶液逐滴滴入到20.00 mL 0.10 mol L-1醋酸溶液中,溶液中的pH曲线与NaOH溶液体积的关系如图所示:

下列有关判断错误的是( )
A. 该温度下,醋酸的Ka的数量级为l0-5 B. N点对应的NaOH溶液体积可能为20.0mL
C. 溶液中,水的电离程度N点比Q点大 D. R点所示溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池。
(1)负极材料是_______(写名称),电极反应式为________。
(2)正极电极反应式为_____________
(3)溶液中SO42-向______极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A. 6:3:2 B. 6:3:1 C. 1:2:3 D. 3:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g) ![]() CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g) ![]() 2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为_________。
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol·L-1 | H2O初始浓度/mol·L-1 |
1 | 400 | P | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2______K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为________。
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则FexOy的化学式为______________。
②“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________。

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题(若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-_____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系c(H2CO3)/c(HCO3-)可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将_______。
A.变大 B.变小 C.基本不变 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
锂一磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+CuSO4+2NH3·H2O= Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的电子排布式:_______________。
(2)PO43-的空间构型是___________________。
(3)P、S元素第一电离能大小关系为_____________________。
(4)氨基乙酸铜分子结构如图,碳原子的杂化方式为_____________,基态碳原子核外电子有
个空间运动状态。

(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1 mol该配合物含有的π键的数目
为____________________。
(6)铜晶体密堆积方式如图所示,铜原子的配位数为_______________,铜的原子半径为127.8pm,NA表示阿伏伽德罗常数的值,列出晶体铜的密度计算式________________g·cm-3

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的说法中正确的是
A. IA族元素都是碱金属元素
B. 碱金属单质可将铜从其盐溶液中置换出来
C. 金属钾具有强还原性,K+具有强氧化性
D. Cs常温下与水反应会发生爆炸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com