
����Ŀ���о�̼���仯������ת������Դ�ij�����á���̼����������Ҫ�����á�
��1����֪:��CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
��2H2(g)+CO(g) ![]() CH3OH(l) ��H2=-128.3kJ��mol-1
CH3OH(l) ��H2=-128.3kJ��mol-1
��2H2(g)+O2(g) ![]() 2H2O(g) ��H3=-483.6kJ��mol-1
2H2O(g) ��H3=-483.6kJ��mol-1
25��ʱ,�ں��ʵĴ���������,���ü��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽΪ_________��
��2�����÷�Ӧ�����Ʊ�����,Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ�����ʡ�ת���ʵ�Ӱ��,ijͬѧ�������������Ա�ʵ��(�¶�Ϊ400���500��,ѹǿΪ101kPa��404kPa)��
ʵ����� | �¶ȡ� | ѹǿ/kPa | CH4��ʼŨ��/mol��L-1 | H2O��ʼŨ��/mol��L-1 |
1 | 400 | P | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
��ʵ��2��ʵ��3���,��ƽ�ⳣ����ϵ��K2______K3(�>������<����=��)��
�ڽ������ʵ�����CH4��ˮ��������1L�����ܱ�������,����������Ӧ,��400���´ﵽƽ��,ƽ�ⳣ��K=27,��ʱ������CO���ʵ���Ϊ0.10mol,��CH4��ת����Ϊ________��
��3����ѧ�������CO2��ȡC��̫���ܹ�����ͼ1��ʾ��
�١�����ϵͳ�������ķ�Ӧ��n(FeO):n(CO2)=6:1,��FexOy�Ļ�ѧʽΪ______________��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�lmolFexOy,ת�Ƶ��ӵ����ʵ���Ϊ________��

��4��pC����pH,��ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10-3mol��L-1,�����Һ�����ʵ�pC=-lg(1��10-3)=3����ͼ2Ϊ25��ʱH2CO3��Һ��pC-pHͼ����ش���������(������Ũ��С��10-5mol/L,����Ϊ�����Ӳ�����):
����ͬһ��Һ��,H2CO3��HCO3-��CO32-_____________(��ܡ����ܡ�)�������档
����H2CO3һ������ƽ�ⳣ������ֵKa1=________________��
������ѪҺ����Ҫͨ��̼�����λ�����ϵc(H2CO3)/c(HCO3-)���Ե�����������,ά��pH=7.4���������������ѪҺ��ʱ,ѪҺ������ϵ�е�c(H+)/c(H2CO3)���ս�_______��
A.��� B.��С C.�������� D.���ж�
���𰸡� CH4(g)+1/2O2(g) ![]() CH3OH(l) ��H1=-164.0kJ/mol > 10/11(90.0%��90.91%��10/11��100%) Fe3O4 2mol ���� 1��10-6 A
CH3OH(l) ��H1=-164.0kJ/mol > 10/11(90.0%��90.91%��10/11��100%) Fe3O4 2mol ���� 1��10-6 A
����������1����֪:��CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
CO(g)+3H2(g) ��H1=+206.1kJ��mol-1
��2H2(g)+CO(g) ![]() CH3OH(l) ��H2=-128.3kJ��mol-1
CH3OH(l) ��H2=-128.3kJ��mol-1
��2H2(g)+O2(g) ![]() 2H2O(g) ��H3=-483.6kJ��mol-1
2H2O(g) ��H3=-483.6kJ��mol-1
���ݸ�˹���ɣ��ɢ�+��+![]() ���۵ã�CH4(g)+
���۵ã�CH4(g)+ ![]() O2(g)
O2(g) ![]() CH3OH(l) ��H1=-164.0KJ/mol��
CH3OH(l) ��H1=-164.0KJ/mol��
��2����Ӧ�������ȷ�Ӧ���¶����ߣ���ѧƽ�������ƶ���Kֵ���ʵ��2���¶ȸ���ʵ��3������K2>K3����������ˮ����ʼ��Ϊx����������ʽ�У�
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼ����x x 0 0
ת������0.1 0.1 0.1 0.3
ƽ������x-0.1 x-0.1 0.1 0.3
��ƽ�ⳣ������ʽK=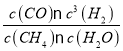 =
=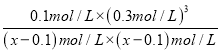 =27�����x=0.11����ƽ��ʱ�����ת����Ϊ��
=27�����x=0.11����ƽ��ʱ�����ת����Ϊ�� ![]() ��100%=90.9%��(3) ����ʾ��ͼ��֪��������ϵͳ����CO2��FeO��Ӧ����FexOy��C�������ķ�Ӧ��n(FeO):n(CO2)=6:1,����������ԭ���غ��֪x:y=6:(6+2)=3:4����FexOy�Ļ�ѧʽΪFe3O4�����ȷֽ���ϵ����Fe3O4�ֽ�ΪFeO���������ֽ�1mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ1mol��3��(
��100%=90.9%��(3) ����ʾ��ͼ��֪��������ϵͳ����CO2��FeO��Ӧ����FexOy��C�������ķ�Ӧ��n(FeO):n(CO2)=6:1,����������ԭ���غ��֪x:y=6:(6+2)=3:4����FexOy�Ļ�ѧʽΪFe3O4�����ȷֽ���ϵ����Fe3O4�ֽ�ΪFeO���������ֽ�1mol Fe3O4ת�Ƶ��ӵ����ʵ���Ϊ1mol��3��(![]() -2)=2mol��(4) ��̼����ڵ���Һ�����Խ�ǿ��̼������Ӵ��ڵ���Һ�м��Խ�ǿ������̼������Ӻ�̼��ܴ������棻����ͼ���֪��PH=6ʱ��Pc(H2CO3)=Pc(HCO3-)�����Ka1(H2CO3)=
-2)=2mol��(4) ��̼����ڵ���Һ�����Խ�ǿ��̼������Ӵ��ڵ���Һ�м��Խ�ǿ������̼������Ӻ�̼��ܴ������棻����ͼ���֪��PH=6ʱ��Pc(H2CO3)=Pc(HCO3-)�����Ka1(H2CO3)=  =
=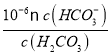 =1��10-6����������Ũ������ƽ�������ƶ��ų�������̼��̼��Ũ�Ȼ������䣬��c(H+)/c(H2CO3)���ս����ѡA��
=1��10-6����������Ũ������ƽ�������ƶ��ų�������̼��̼��Ũ�Ȼ������䣬��c(H+)/c(H2CO3)���ս����ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�з�Ӧ���������������������������ǣ� ��
A. �Ҵ�ȼ�� B. ̼��Ʒֽ� C. ��������������ĩ��Ӧ D. ����������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������мȺ������Ӽ��ֺ��й��ۼ�����
A. Na2O B. H2O C. Na2O2 D. Na2S
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. �۲���������Ԥ����Ļ�ѧ��������ʵ�鲢�۲�ʵ�����������������ͣ��ó�����
B. �۲�����������ʵ�鲢�۲�ʵ�����������������ͣ��ó�����
C. ��ʵ�鲢�۲�ʵ�����������������ͣ��ó�����
D. Ԥ�������������ʵ�鲢�۲�ʵ�����������������ͣ��ó��������۲�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п��ũҩ�����Ϻ������ճ������о��й㷺��Ӧ�á���ش��������⣺
��1����̬Sԭ���У��������ռ�ݵ�����ܼ�����Ϊ______�����������״Ϊ______����̬Znԭ�ӵļ۵����Ų�ʽΪ______��
��2�������������CH3CSNH2)��������Һ��ˮ�����H2S�������H2S����Һ����������ʹ�á�1 mol CH3CSNH2���Цм�Ϊ______mol����������Cԭ�ӵ��ӻ���ʽ�ֱ�Ϊ_______��
��3��H2S�۵�Ϊ-85.5�棬������������ƽṹ��H2O���۵�Ϊ0�棬������ɹ��壬�����������ʳ��ִ˲����ԭ����____________________��
��4��ZnS�������ư�ɫ�����ϼ�����������ۡ������ϡ���������ȡ������ṹ��ͼ��ʾ��

��һ��ZnS�����ṹ�У�S����ĿΪ ______�����þ����߳�Ϊ540.0 pm�������ܶ�Ϊ_______gcm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯��ͭ��CuH����һ���������ʣ���CuSO4��Һ�͡���һ���ʡ���40��50��ʱ��Ӧ����������CuH���е������У����ȶ����ֽ⣻����������ȼ�գ���ϡ���ᷴӦ���������壻Cu�������������·����ķ�Ӧ�ǣ�2Cu��=Cu2����Cu��
����������Ϣ������Լ������յĻ�ѧ֪ʶ���ش��������⣺
��1����CuSO4��Һ�͡���һ���ʡ���CuH�ķ�Ӧ�У���������ԭ�۵�������⡰��һ���ʡ��ڷ�Ӧ��������______��
��2��д��CuH��������ȼ�յĻ�ѧ��Ӧ����ʽ��___________��
��3��CuH�ܽ���ϡ���������ɵ�������___________�������Ӧ�������˱�״����22.4L�����壬����ԭ�����ӵõ��ӵ����ʵ�����__________��
���ø�Ч�Ķ������ȣ�ClO2�����Һ�Ƚ����������ɱ�����������彡���к����л��ȴ��
��1����ҵ�ϣ�ClO2����NaClO3��Na2SO3��Һ��ϲ��������ữ��Ӧ�Ƶã���ѧ��Ӧ����ʽΪ___��
��2����Ч�Ⱥ����Ǻ�����������һ����Ҫָ�꣬��Ч�Ⱥ����Ķ���Ϊ����HI����������ͬ����I2����Cl2��������ָ������������������֮�ȣ����ðٷ�����ʾ����ClO2����Ч�Ⱥ�����_______��
��3��ijͬѧ������ClO2������������ˮ������Ԫ�غ����IJⶨ���ٶ�ClO2ȫ��ת��ΪCl���������ǽ���������ʵ�飺��30.00 mLˮ���мӼ���K2CrO4��Һ��ָʾ������0.001 mol��L��1AgNO3��Һ�ζ�������ש��ɫAg2CrO4��������ʱ����ζ��յ㣬��ʱ��ȥAgNO3��Һ12.12 mL��
��ˮ����Cl�������ʵ���Ũ����_______________��
����֪Ksp(AgCl) = 1.78��10-10��Ksp(Ag2CrO4) = 2.00��10-12�����ڵζ��յ�ʱ�������Һ��CrO42����Ũ����5.0��10��3mol��L��1���Լ����ʱ��Һ��Cl����Ũ����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������˸�ǿ�ȡ������ܵķ����Ͻ���¸֣���Ԫ�ص�ԭ������Ϊ23����ԭ�ӵ���Χ�����Ų�ʽ��ȷ���ǣ�������
A.3s23p6B.3d34s2
C.3d64s2D.4s2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ͬ���칹����Ŀ����������ȷ����:
A. �ױ������ϵ�һ����ԭ�ӱ���3��̼ԭ�ӵ����ȡ�������ò�����6��
B. �� ��Ϊͬ���칹��ķ����廯������5��
��Ϊͬ���칹��ķ����廯������5��
C. ����5��̼ԭ�ӵı�����������һ��ȡ������3��
D. �ƵĽṹ��ʽΪ ���������ᷴӦ��������5��һ����ȡ����
���������ᷴӦ��������5��һ����ȡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����ܱ������г���2 mol SO2��1mol O2����һ�������·�����Ӧ��2SO2��O2![]() 2SO3�������й�˵����ȷ����
2SO3�������й�˵����ȷ����
A. �ﵽ��ѧƽ��ʱ������Ӧ���淴Ӧ�����ʶ�Ϊ��
B. ��O2��Ũ�Ȳ���ʱ����Ӧ�ﵽƽ��״̬
C. ����λʱ������a mol O2��ͬʱ����2a mol SO2ʱ����Ӧ�ﵽƽ��״̬
D. ��SO2��O2��SO3�ķ�������Ϊ2��1��2����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com